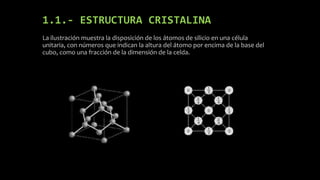
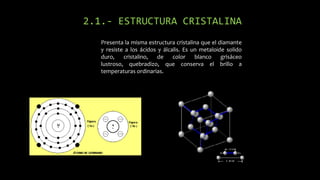
Este documento describe las propiedades y aplicaciones del silicio, germanio y galio. El silicio es el segundo elemento más abundante en la Tierra y se presenta de forma amorfa o cristalina, siendo un semiconductor utilizado ampliamente en la electrónica. El germanio comparte propiedades con el silicio y se usa en circuitos de alta velocidad. El galio es un metal blando que se funde cerca de la temperatura ambiente y se emplea en semiconductores y aleaciones de bajo punto de fusión.