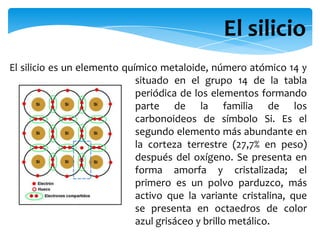
El documento describe las propiedades cristalinas del silicio, germanio y galio. Explica que el silicio se puede encontrar en tres estados cristalinos y que depende de su cristalinidad se pueden aplicar diferentes métodos para extraerlo y utilizarlo. También discute la absorción y el coste como factores importantes. Luego proporciona detalles sobre las características atómicas y de enlace de cada elemento, incluidos sus puntos de fusión, ebullición, estructura cristalina y usos principales.


![Número Atómico: 14
Masa Atómica: 28,0855
Número de protones/electrones: 14
Número de neutrones (Isótopo 28-Si): 14
Estructura electrónica: [Ne] 3s2 3p2
Electrones en los niveles de energía: 2, 8, 4
Números de oxidación: -4, +2, +4
Electronegatividad: 1,90
Energía de ionización (kJ.mol-1): 786
Afinidad electrónica (kJ.mol-1): 134
Radio atómico (pm): 118
Radio iónico (pm) (carga del ion): 26 (+4), 271 (-4)
El silicio
Símbolo: Si
Clasificación: Elementos carbonoides Grupo 14 Metaloide](https://image.slidesharecdn.com/slidoscristalinos-130418142948-phpapp01/85/Solidos-cristalinos-4-320.jpg)
![Entalpía de fusión (kJ.mol-1): 39,6
Entalpía de vaporización (kJ.mol-1): 383,3
Punto de Fusión (ºC): 1414
Punto de Ebullición (ºC): 3265
Densidad (kg/m3): 2329; (20 ºC)
Volumen atómico (cm3/mol): 12,06
Estructura cristalina: Cúbica
Color: El silicio cristalino es gris con brillo
metálico. El amorfo es marrón.
Descubierto en: 1822
Descubierto por: Berzelius (silicio amorfo) y Deville (1854) (silicio cristalino)
Fuentes: Sílice y otros minerales: olivino [(Mg,Fe)2(SiO4)], granate
[Ca3Al2(SiO4)3], espodumena [(LiAl)(Si2O6)], talco [Mg3(Si4O10)(OH)2]
Usos: Semiconductores (hiperpuro o dopado con boro, galio, fósforo o arsénico):
transistores, células solares, rectificadores y otros dispositivos de estado sólido;
vidrios, material refractario, porcelanas, cementos, aleaciones (ferrosilicio). El silicio
amorfo hidrogenado se emplea en células solares
El silicio](https://image.slidesharecdn.com/slidoscristalinos-130418142948-phpapp01/85/Solidos-cristalinos-5-320.jpg)


![Símbolo: Ge
Clasificación: Elementos carbonoides Grupo 14 Metaloide
Número Atómico: 32
Masa Atómica: 72,61
Número de protones/electrones: 32
Número de neutrones (Isótopo 73-Ge): 41
Estructura electrónica: [Ar] 3d10 4s2 4p2
Electrones en los niveles de energía: 2, 8, 18, 4
Números de oxidación: +2, +4
Electronegatividad: 2,01
Energía de ionización (kJ.mol-1): 784
Afinidad electrónica (kJ.mol-1): 116
Radio atómico (pm): 122
Radio iónico (pm) (carga del ion): 272(-4), 90(+2)
Germanio](https://image.slidesharecdn.com/slidoscristalinos-130418142948-phpapp01/85/Solidos-cristalinos-8-320.jpg)
![Entalpía de fusión (kJ.mol-1): 34,7
Entalpía de vaporización (kJ.mol-1): 334,3
Punto de Fusión (ºC): 938,25
Punto de Ebullición (ºC): 2833
Densidad (kg/m3): 5323; (25 ºC)
Volumen atómico (cm3/mol): 13,64
Estructura cristalina: Cúbica
Color: Grisáceo
Germanio
Descubierto en: 1886
Descubierto por: C. Winkler
Fuentes: Refinado de cobre, cinc, plomo. Productos de combustión de ciertos carbones.
Minerales: argirodita [4Ag2S.GeS2], germanita [FeCu6GeS8, que contiene hasta un 8% del
elemento y galio, arsénico y cinc].
Usos: Semiconductores y transistores. En forma de monocristales para la fabricación de
elementos ópticos (lentes, prismas y ventanas) para espectroscopía infrarroja:
Espectroscopios, detectores de infrarrojos. El alto índice de refracción del óxido de
germanio lo hace útil para la fabricación de lentes gran angular de cámaras fotográficas y
objetivos de microscopio. Aleaciones (alguna con niobio y aluminio es superconductora a
20,7 K). Catalizador.](https://image.slidesharecdn.com/slidoscristalinos-130418142948-phpapp01/85/Solidos-cristalinos-9-320.jpg)



![Símbolo: Ga
Clasificación: Elementos térreos Grupo 13 Otros Metales
Número Atómico: 31
Masa Atómica: 69,723
Número de protones/electrones: 31
Número de neutrones (Isótopo 70-Ga): 39
Estructura electrónica: [Ar] 3d10 4s2 4p1
Electrones en los niveles de energía: 2, 8, 18, 3
Números de oxidación: +1, +3
Electronegatividad: 1,81
Energía de ionización (kJ.mol-1): 577
Afinidad electrónica (kJ.mol-1): 29
Radio atómico (pm): 153
Radio iónico (pm) (carga del ion): 113(+1), 62(+3)
Galio](https://image.slidesharecdn.com/slidoscristalinos-130418142948-phpapp01/85/Solidos-cristalinos-13-320.jpg)
![Entalpía de fusión (kJ.mol-1): 5,59
Entalpía de vaporización (kJ.mol-1): 256,1
Punto de Fusión (ºC): 29,76
Punto de Ebullición (ºC): 2204
Densidad (kg/m3): 5906; (20 ºC)
Volumen atómico (cm3/mol): 11,81
Estructura cristalina: Ortorrómbica
Color: Blanco con brillo plateado.
Descubierto en: 1875
Descubierto por: P. E. Lecoq de Boisbaudran
Fuentes: Minerales: galita [CuGaS2], sohngeita [Ga(OH)3], germanita. Trazas del
elemento se encuentran en diásporo, esfalerita, bauxita y carbón (en algunas cenizas
de chimeneas donde se quema carbón se ha encontrado que contienen hasta 1,5% de
galio).
Usos: Semiconductores (arseniuro de galio) (transistores, memoria de
ordenadores), aleaciones para fusibles (de bajo punto de fusión), aleaciones
superconductoras a baja temperatura, aparatos de medida de temperatura (600 a 1200
ºC en estado líquido), materiales magnéticos, espejos.
Galio](https://image.slidesharecdn.com/slidoscristalinos-130418142948-phpapp01/85/Solidos-cristalinos-14-320.jpg)
