Descripción del átomo según la mecánica cuántica
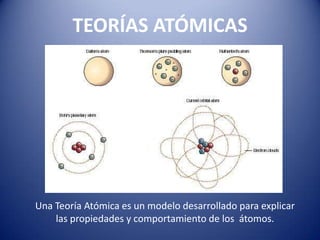
- 1. TEORÍAS ATÓMICAS Una Teoría Atómica es un modelo desarrollado para explicar las propiedades y comportamiento de los átomos.
- 2. TEORÍA ATÓMICA DE DALTON La esencia de la teoría atómica de la materia de Dalton (Químico Inglés 1766-1844) se resume en estos postulados: Toda la materia está compuesta de partículas muy pequeñas llamadas átomos. Todos los átomos de un mismo elemento son semejantes en masa (peso) y otras propiedades, pero los átomos de otro elemento tienen masa y propiedades distintas. Los átomos no pueden crearse ni destruirse durante una reacción química. En las reacciones químicas los átomos se combinan o se separan de otros átomos. En cada uno de sus compuestos, los diferentes elementos se combinan en una proporción numérica sencilla: así por ejemplo, un átomo de A con un átomo de B (AB), o un átomo de A con dos átomos de B (AB2).
- 3. PREGUNTA Which of the following is not a postulate of Dalton's atomic theory? different elements have atoms of different masses chemical change is a rearrangement of atoms atoms are not created or destroyed in chemical change atoms of a single element can have different masses atoms combine in simple whole number ratios to form compounds
- 4. MODELOS ATÓMICOS Joseph Thomson 1856-1940 Modelo Estático: “El pudín de pasas” Los electrones se distribuyen uniformemente sobre una masa de carga positiva. http://www.youtube.com/watch?v=lv0_OYKdmdw&feature=fvw ErnestRutherford 1871-1937 Atomo nuclear: Casi toda la masa del átomo se concentra en el núcleo. Los electrones giran a grandes distancias en órbitas circulares alrededor (gran parte es espacio vacío). NielsBohr 1885-1962 Atomo planetario: Los electrones giran a grandes velocidades alrededor del núcleo, en diversas órbitas que determinan diferentes niveles de energía.
- 5. EXPERIMENTO CON TUBO DE RAYOS CATÓDICOS: THOMSON
- 6. TUBO DE RAYOS CATÓDICOS
- 7. EXPERIMENTO CON PARTÍCULAS ALPHA: RUTHERFORD
- 8. TALLER DE MODELOS ATÓMICOS Who was the first person to suggest that the atom was made up of smaller parts? (a)ErnestRutherford (b) J. J. Thomson (c) James Chadwick (d) John Dalton (2) Cathode rays are beams of: (a)alphaparticles (b)electrons (c)neutrons (d)protons
- 9. TALLER DE MODELOS ATÓMICOS (3) Based on his experiments, what did Rutherford propose? (a) the nucleus is positively charged (b) atoms are mostly empty space (c) atoms had a dense nucleus (d) all of the choices (4) Theproton has: (a) the opposite charge and a larger mass than the electron (b) the opposite charge and a smaller mass than the electron (c) the same charge and a smaller mass than the electron (d) the same charge and the same mass as the electron
- 10. (9) Which of the following is a valid definition of atomic weight? Atomicweightis: (a) the number of electrons in an atom (b) the number of protons and electrons (c) the number of protons and neutrons (d) the number of protons in an atom (10) Which is the correct organization of the subatomic particles in an atom? (a) Electrons reside inside of a small nucleus. Protons and neutrons revolve around the nucleus. (b) Neutrons and electrons reside inside of a small nucleus. Protons revolve around the nucleus. (c) Protons and electrons reside inside of a small nucleus. Neutrons revolve around the nucleus. (d) Protons and neutrons reside inside of a small nucleus. Electrons revolve around the nucleus. (e) Protons and electrons reside inside of a small nucleus. Neutrons revolve around the nucleus.
- 11. EL NEUTRÓN En 1932, James Chadwick descubrió un tercer tipo de partícula sub-átomica a la que llamó el Neutrón. Ayudan a estabilizar los protones en el núcleo del átomo al reducir la repulsión entre ellos . Los neutrones siempre residen en el núcleo de los átomos y son aproximadamente del mismo tamaño que los protones. No tienen una carga eléctrica, más bien son eléctricamente neutrales.
- 12. ISÓTOPOS, NÚMERO ATÓMICO Y NÚMERO MÁSICO NÚMERO ATÓMICO (Z)ES EL N. PROTONES = N. ELECTRONES (Átomo neutro). El N. de protones de un elemento no cambia. NÚMERO MÁSICO (A) : PROTONES + NEUTRONES DE UN ÁTOMO ISÓTOPOS: ÁTOMOS DE UN MISMO ELEMENTO, PERO CON DIFERENTE CANTIDAD DE NEUTRONES EN EL NÚCLEO.
- 13. ISÓTOPOS En general las propiedades químicas de un elemento están determinadas fundamentalmente por los protones y electrones de sus átomos y en condiciones normales los neutrones no participan en los cambios químicos. Por ello los isótopos de un elemento tendrán un comportamiento químico similar, formarán el mismo tipo de compuestos y reaccionarán de manera semejante.
- 14. MASA ATÓMICA La masa atómica relativa de un elemento, es la masa en gramos de 6.02 ·1023 átomos (número de Avogadro, NA) de ese elemento. El átomo de carbono, con 6 protones y 6 neutrones, es el átomo de carbono 12 y es la masa de referencia para las masas atómicas. Una unidad de masa atómica (u.m.a), se define exactamente como 1/12 de la masa de un átomo de carbono que tiene una masa 12 u.m.a. una masa atómica relativa molar de carbono 12 tiene una masa de 12 g en esta escala.
- 15. TALLER VERDADERO O FALSO Dos compuestos de igual peso molecular se dice que son isótopos. ____ El átomo de potasio, K, se convierte en ión potasio perdiendo un electrón. Por tanto si el peso atómico del K es 39, el del ión potasio será 40. ____ La estructura del átomo de aluminio (número atómico, 13; número másico 27) es la siguiente: El núcleo está formado por 13 protones y 14 neutrones; la nube electrónica presenta 13 electrones. ____ ¿Cuáles de los siguientes pares son isótopos? 2H+ y 3H 3He y 4He 12C y 14N+3H y 4He+ 5. Un elemento con número atómico 79 y número másico 197 tiene: 79 protones, 118 neutrones y 79 electrones 78 protones, 119 neutrones y 79 electrones 79 protones, 118 neutrones y 197 electrones 118 protones, 118 neutrones y 79 electrones
- 16. DESCRIPCIÓN DEL ÁTOMO SEGÚN LA MECÁNICA CUÁNTICA Los objetos de gran tamaño obedecen las leyes de la mecánica clásica (Newton). Partículas muy pequeñas como electrones, átomos y moléculas no las siguen, su comportamiento es descrito por la MECANICA CUÁNTICA basada en las propiedades ondulatorias de la materia.
- 17. RADIACIÓN ELECTROMAGNÉTICA En 1873 James Maxwellpropusoque la luz visible se compone de ondaselectromagnéticas, con un componente de campo eléctrico y un componente de campo magnético. Ambos tienen la mismalongitud de onda y frecuencia, y viajan en planosperpendiculares entre si. La radiaciónelectromagnéticaes la emisión y transmisión de energía en forma de ondaselectromagnéticas.
- 18. c = ƛ.ν c Velocidad de la luz ƛ Longitud de onda ν Frecuencia UNIDADES: ƛ = m, cm o nm ν = Hertz, Hz = 1 ciclo/seg Hz = 1/s
- 19. TEORÍA CUÁNTICA DE PLANCK Max Planck en 1900, propusoque los átomos y lasmoléculasemiten o absorbenenergía solo en cantidadesdiscretas, comosiestaestuvieraempaquetada en pequeñas unidades. Cuanto: Mínima cantidad de E que se puede emitir. E = hv E: Energía de 1 cuanto h: Constante de Planck= 6,63x10-34 J.s
- 20. ALBERT EINSTEIN Un rayo de luz es un torrente de partículas llamadas FOTONES. “La radiación tiene propiedades tanto corpusculares como ondulatorias: es una onda que al interactuar con la materia manifiesta un comportamiento corpuscular” PREGUNTA Calcule la energía en Joules de un fotón con una longitud de onda de 5x104 nm. (1 nm= 1x10-9 m)
- 21. PRINCIPIOS FUNDAMENTALES DE LA MECÁNICA CUÁNTICA Ppio. De incertidumbre de Heisenberg (1927): “Es imposible determinar con exactitud el momentum (mv) y la posición de un electrón, de manera simultánea (o de cualquier otra partícula de tamaño muy pequeño)”. 1. Los átomos y moléculas solo pueden existir en determinados estados de energía. En cada estado tienen energía definida. Cuando cambian de estado de energía, deben emitir o absorber suficiente energía para llegar al nuevo estado.
- 22. PRINCIPIOS FUNDAMENTALES DE LA MECÁNICA CUÁNTICA 2. Los átomos y moléculas emiten o absorben radiación (luz) cuando sus energías cambian. 3. Los estados de energía permitidos para los átomos y moléculas pueden describirse mediante conjuntos de números conocidos como números cuánticos. Ppio. De exclusión de Pauli (1900/58): “Dos electrones de un mismo átomo no pueden tener sus cuatro números cuánticos iguales”
- 23. LA ECUACIÓN DE SCHRODINGER Desarrollada por el físico austriaco Erwin S. en 1925 y representa las probabilidades de resultados de todas las medidas posibles de un sistema. La evolución temporal de se describe por la ecuación de Schrödinger : NÚMEROS CUÁNTICOS
- 24. NÚMEROS CUÁNTICOS LA ECUACIÓN DE SCHRODINGER Describe un estado de energía posible para los electrones del átomo. Cada solución se compone de 3 números cuánticos que concuerdan con el cálculo experimental de la probabilidad de ubicar un electrón. De aquí se deducen los orbitales atómicos.
- 25. NÚMEROS CUÁNTICOS Un orbital atómico, es la región del espacio en la que hay mayor probabilidad de encontrar un electrón. Número cuántico principal, n, describe el nivel de energía principal que el electrón ocupa. n = 1, 2, 3, 4… 2. Número cuántico subsidiario (o azimutal), l indica el subnivel o la forma de la región del espacio que ocupa el electrón. l = 0, 1, 2, 3…(n-1) s, p, d, f …..
- 26. NÚMEROS CUÁNTICOS 3. El número cuántico magnético, ml indica la orientación espacial del orbital atómico. En cada subnivel, puede valer entre –l y +l pasando por el cero (0) p.e. para el subnivel 1 o p, hay 3 orbitales atómicos: -1, 0 y 1 o px, pyy pz 4. El número cuántico de giro, ms Se refiere al giro del electrón y a la orientación del campo magnético que este produce y puede ser: ms=+1/2 o ms=-1/2
- 28. LLENADO DE ORBITALES La forma en que los electrones están dispuestos en el átomo se llama Configuración Electrónica del átomo. En los diagramas de orbitales, cada orbital se representa con una raya y un electrón con una flecha hacia arriba o hacia abajo según su spin: Litio: Li __ __ La Notación Electrónica resume la configuración electrónica en números y letras, así: 1s1
- 30. PREGUNTAS El átomo de Oxígeno tiene un total de 8 electrones, escriba los 4 números cuánticos para cada electrón en su estado fundamental. Escriba las configuraciones electrónicas del azufre (S) y del paladio (Pd) en su estado fundamental.
- 31. RESPUESTAS