Titanio
•Descargar como PPT, PDF•
1 recomendación•18,920 vistas
El documento proporciona información sobre el titanio, un metal de transición de color gris plateado. Describe sus propiedades físicas y químicas, incluido su punto de fusión alto, baja densidad y resistencia a la corrosión. También resume su descubrimiento, procesos de obtención, usos principales en la industria aeroespacial y aplicaciones médicas debido a su biocompatibilidad.
Denunciar
Compartir
Denunciar
Compartir
Recomendados
Recomendados
Más contenido relacionado
La actualidad más candente
La actualidad más candente (20)
Destacado
Destacado (20)
2do conversatorio del cicloA2011 Las nanoparticulas Magnéticas unos de los pi...

2do conversatorio del cicloA2011 Las nanoparticulas Magnéticas unos de los pi...
Titânio - Materiais de Construção Mecânica. SENAI LTA Camaçari

Titânio - Materiais de Construção Mecânica. SENAI LTA Camaçari
Similar a Titanio
Similar a Titanio (20)
Exposicion quimica carlos villacreces jose guzman marcos sanchez (2)

Exposicion quimica carlos villacreces jose guzman marcos sanchez (2)
Locura cósmica final (aleación del aluminio y el titanio)

Locura cósmica final (aleación del aluminio y el titanio)
Locura cósmica final (aleación del aluminio y el titanio)

Locura cósmica final (aleación del aluminio y el titanio)
Más de mamen
Más de mamen (20)
Último
Último (20)
5° SEM29 CRONOGRAMA PLANEACIÓN DOCENTE DARUKEL 23-24.pdf

5° SEM29 CRONOGRAMA PLANEACIÓN DOCENTE DARUKEL 23-24.pdf
VOLUMEN 1 COLECCION PRODUCCION BOVINA . SERIE SANIDAD ANIMAL

VOLUMEN 1 COLECCION PRODUCCION BOVINA . SERIE SANIDAD ANIMAL
PLANIFICACION ANUAL 2024 - INICIAL UNIDOCENTE.docx

PLANIFICACION ANUAL 2024 - INICIAL UNIDOCENTE.docx
PPT GESTIÓN ESCOLAR 2024 Comités y Compromisos.pptx

PPT GESTIÓN ESCOLAR 2024 Comités y Compromisos.pptx
BIOLOGIA_banco de preguntas_editorial icfes examen de estado .pdf

BIOLOGIA_banco de preguntas_editorial icfes examen de estado .pdf
Presentación de Estrategias de Enseñanza-Aprendizaje Virtual.pptx

Presentación de Estrategias de Enseñanza-Aprendizaje Virtual.pptx
c3.hu3.p1.p2.El ser humano y el sentido de su existencia.pptx

c3.hu3.p1.p2.El ser humano y el sentido de su existencia.pptx
Mapa Mental de estrategias de articulación de las areas curriculares.pdf

Mapa Mental de estrategias de articulación de las areas curriculares.pdf
LINEAMIENTOS INICIO DEL AÑO LECTIVO 2024-2025.pptx

LINEAMIENTOS INICIO DEL AÑO LECTIVO 2024-2025.pptx
Titanio
- 1. EL TITANIO
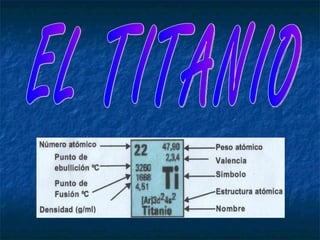
- 3. Volumen atómico (cm3/mol): 10,62 Punto de ebullición (ºC): 3287 Punto de fusión (ºC): 1668 Color: Plateado Densidad (g/cm3): 4,507 PROPIEDADES FÍSICAS Afinidad electrónica (kJ/mol): 7,6 Electronegatividad: 1,54 Energía de ionización (kJ/mol): 658 Radio covalente (Å): 1,36 Radio iónico (Å): 0,68 (+4) Radio atómico (Å): 1,47 Configuración electrónica: [Ar] 3d2 4s2 PROPIEDADES PERIÓDICAS Valencias: +2, +3, +4 Bloque: d (no representativo) Grupo: IVB (transición) Período: 4 Masa atómica (uma): 47,867 Número atómico: 22 Símbolo: Ti Nombre: Titanio CARACTERÍSTICAS GENERALES