Introducción a la Química
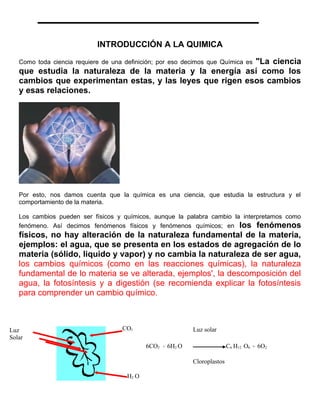
- 1. INTRODUCCIÓN A LA QUIMICA "La ciencia Como toda ciencia requiere de una definición; por eso decimos que Química es que estudia la naturaleza de la materia y la energía así como los cambios que experimentan estas, y las leyes que rigen esos cambios y esas relaciones. Por esto, nos damos cuenta que la química es una ciencia, que estudia la estructura y el comportamiento de la materia. Los cambios pueden ser físicos y químicos, aunque la palabra cambio la interpretamos como fenómeno. Así decimos fenómenos físicos y fenómenos químicos; en los fenómenos físicos, no hay alteración de la naturaleza fundamental de la materia, ejemplos: el agua, que se presenta en los estados de agregación de lo materia (sólido, liquido y vapor) y no cambia la naturaleza de ser agua, los cambios químicos (como en las reacciones químicas), la naturaleza fundamental de lo materia se ve alterada, ejemplos', la descomposición del agua, la fotosíntesis y a digestión (se recomienda explicar la fotosíntesis para comprender un cambio químico. Luz CO2 Luz solar Solar 6CO2 + 6H2 O C6 H12 O6 + 6O2 Cloroplastos H2 O
- 2. Entendemos como materia, a cualquier cosa que tenga masa y ocupe espacio; y que para estudiarla se clasifica en cualquiera de los tres estados de agregación que presenta: a) Sólido, que tiene forma y volumen definido. b) Liquido, que tiene volumen fijo, pero no forma definida. c) Gas: ni forma ni volumen definido. I. Ley de la conservación de la materia (de Antonie Laurent Lovoisier). “En el universo la materia no se crea ni se destruye únicamente se transforma”. II. Ley de la conservación de lo energía: "En el universo la energía no se crea ni se destruye solamente se transforma". Esta ley surge como necesidad por los adelantos tecnológicos desde el siglo XIX y da lugar o la termodinámica y lo Fisicoquímica. Como consecuencia de las dos leyes anteriores, la ciencia se ve en la necesidad de crear una ley que conjugue los dos aspectos. III. Ley de la conservación de la materia y la energía: "En el universo la materia y la energía puede transformarse mutuamente, pero la suma total de ambas, materia y energía del universo no puede aumentar ni disminuir", Se entiende como masa cantidad de materia que contiene una sustancio y a la que tiene propiedades, cambios, estados de agregación y clases. No debemos confundir el concepto de masa con el de peso, ya que este ultimo es una medida de atracción de lo gravedad que ejerce el planeta hacia la sustancia. W = mg Unidades: SI: N (Newton) CGS: D (dinas) MKS Tec: KGF. Ingles: Lbf
- 3. Volumen, peso inercia, porosidad, Generales elasticidad, impenetrabilidad, etc. Físicas Densidad, punto de fusión, punto de I) Sus propieda ebullición, conductividad des. Especificas. Oxidación, reducción, Químicas electronegatividad, acidez, alcalinidad, etc. Físicas No se altera, la naturaleza de la materia II) Cambios Químicas Masa Si se altera la naturaleza de la materia Presentan cambios de estado: Sólido Fusión solidificación. III) Estados de Liquido Agregación Gas (vapor) Evaporación condensación. Licuefacción sublimación Homogéneas (soluciones y compuestos) IV) Sus clases y sistemas Heterogéneas (todas las mezclas coloides)
- 4. ESTRUCTURA ATÓMICA Democrito y los griegos consideraban que toda la materia estaba formada por cuatro elementos: tierra, viento, fuego y agua. En 1803 John Dalton emplea el concepto del átomo, para decirnos que, “Toda la materia esta formada por partículas diminutas indivisibles llamadas átomos (del griego: a sin, tomos – división.) En 1897 John Joseph Thomson trabajando con tubos al vacío descubre el electrón (del griego electrón) lo que llevo a desarrollar un modelo atómico. (+) ( - ) Cargas Eléctricas Negativas BUDIN CON CIRUELA(O PASAS) Ernest Rutherford EN 1911 probo con sus experimentos que los electrones están afuera girando alrededor de una estructura densa de carga positiva (protón o protones: del griego Primario) a la que llamo núcleo. Nieis Bohr en 1913 postulo que los electrones están confinados en órbitas definidas (capas) alrededor del núcleo para, mantener ahí una energía o "estado basal", si un electrón "brinca" hacia una capa superior esta tomando energía, pero si desciende a niveles inferiores o del lugar de donde partió libera la energía tomada anteriormente. (Reloj fosforescente.) Para Bohn y la nuevo mecánico quántica coinciden con la distribución de los electrones, como decía Rutherford es decir un " sistema planetario" con un numero definido de electrones en cada capa.
- 5. Núcleo Positivo. Capa(s) Con número definido de electrones. Modelo de Rutherford - Bohr Los adelantos tecnológicos hicieron que entre 1929 y 1932 el científico James Chadwick descubriera el neutrón presente en el núcleo, con una masa semejante al protón ( + ) pero con característicos de que no tiene carga eléctrica. Entonces un átomo consta de un núcleo que tiene protones y neutrones, pero girando alrededor de este en capas los electrones. Energía "Es la capacidad o aptitud de un cuerpo para realizar un trabajo”. Siendo las 2 formas básicas de la energía: cinética y potencial. Tanto la eólica, luminosa, mecánica, eléctrica, calorífica, etc., no son mas que manifestaciones de las formas básicas. Energía cinética. La capacidad de un cuerpo para realizar un trabajo en virtud de su movimiento, que algebraicamente lo representamos. 2 Ec = 1 m V 2 Para SI se mide en Joules ( J ), en CGS : ergs Energía Potencial. Es la capacidad para desarrollar un trabajo en función de posición un, estado o altura, algebraicamente la representamos. Ep = mgh
- 6. Se mide en joules (J), en CGS ergs o ergio. Relación materia-energía en 1905 Albert Einstein propuso que "la energía resulta de una conversión de la masa y como de una pequeña cantidad de masa, se puede producir una tremenda cantidad de energía. En cualquiera de los casos se cumple la ley de la conservación de la energía “En el universo la energía no se crea ni se destruye solo se trasforma”. E = energía E=mc2 m = masa C = velocidad de la luz En México, las principales fuentes energéticas son : el petróleo que proporciona hidrocarburos; la energía eléctrica, que proviene de complejos Termoeléctricos e hidroeléctricos. En el futuro se aprovechara la energía solar, la nuclear y la biomasa. BREVE ESTUDIO DE LA TABLA PERIÓDICA Tal y como conocemos hoy la tabla periódica, fue diseñada por Dmitri Mendeleev y Lothar Mayer en el siglo XVII, Y ESTA BASADA EN QUE “Las propiedades de los elementos y sus funciones son funciones periódicas del numero atómico del elemento de sus masas o pesos atómicos crecientes”. Aunque la versión moderna nos dice que: “Las propiedades de los elementos y de sus compuestos son una función periódica del núcleo atómico”. Por leer lo tabla periódica, se puede hacer cualquiera de las siguientes dos formas: Horizontal y entonces hablamos de periodos, o bien verticalmente y entonces hablamos de grupos o familia, con lo cual vemos que hay 7 periodos señalados con un numero arábigo y corresponde a las siete capas del modelo atómico de Rutherford - Bohr en cambio los grupos son 16 divididos en dos bloques A y B con distribución de números romanos.
- 7. PERIODOS IA VIIIA G 1 G R IIA IIIA IVA VA VIA VIIA A U S A G G G P 2 L R R R E O S C U U U S A P P P N 3 A L O O O C H O O L I A A B C N D D D L L L F 4 A L O S E L E L E L C O O G E A S I G E M ELEMENTOS DE N T B C N E N I 5 O E TRANSICION. O A I N O O (Todos son metales) L S R R R T O S I I R O B R S N A 6 I O O E O N G R S S O E T 7 N O E S LANTANIDOS TIERRAS RARAS ACTINIDOS ELECTRONEGATIVIDAD ELECTROPOSITIVIDAD Los elementos son mas electronegativos con forme avanzamos a la derecha del periodo. Toman electrones pero si leemos hacia la izquierda los elementos son mas electropositivos (ceden fácilmente los electrones). Ahora viendo la tabla en forma micro, es decir tomando a un elemento para analizar cada una de las informaciones que nos proporciona el elemento, así tomando al que se encuentra en el 4º periodo grupo IIA:
- 8. Masa atómica (peso atomico) Numero Atómico 20 40.08 Número de protones en número de protones en el núcleo nucleo , (como el átomo + núcleo de neutrones en es 2 eléctricamente neutro el nucleo Ca es igual número de electrones.) Valencia o número de oxidación (Capacidad de combinación del Elemento y que esta dado por los electrones de la última etapa.) De lo tabla periódica podemos obtener tres conceptos mas, de gran importancia; ion, isótopo y alótropo. Ion: Partícula cargada eléctricamente, que proviene de la perdida ( o eliminación) o ganancia de electrones (cationes (+) y aniones(-) lo que significa que atomo no se encuentra estado neutro.) Isótopo : (del griego isos; mismo, topos, lugar): Se dice de los elementos que ocupan el mismo lugar en la tabla periódico y que presento igual Numero Atómico, pero diferente masa atómica, ejemplos; hidrógeno (H), Carbono (C), y Uranio (U). Basándose en el teorema de Rutherford – Bohr ejemplificado . Ejemplifiquemos H1 H2 H3 +P N N p+ N P TRITIO PROTÒN DEUTERÒN
- 9. Para conocer el número de neutrones de isótopo se hace las diferencia del número de masa atómica, menos el número atómico, así: 1 2 3 -1 -1 -1 0 Neutrón para el protón 1 Neutròn para el deuterón 2 Neutrones Pára el tritio Concepto de radio atómico: Este se define como la distancia comprometida entre el centro del núcleo y el nivel externo de un átomo. Generalmente crece con el número atómico, ya que al aumentar un nivel de energía la distancia entre el centro del núcleo el nivel también crece en cada periodo el radio atómico disminuye de izquierda a derecha, debido a la contracción de la nube electrónica al ser atraída por el núcleo, el radio atómico se expresa en ángstrom (AB) IAº= 1x10 -cm =1x108 Cuando un elemento metálico pierde electrones , su radio disminuye ejemplo: r r Pero cuando un elemento no metálico gana electrones, su radio se ve incrementado, ejemplo: rcl-= 1.9A rcl=0.9 A Energía de iniciación : Es la energía necesaria para arrancar un electrón de un átomo aislado en estado gaseoso; de aquí a que unos átomos tiendan a perder electrones y convertirse en iones positivos, mientras que otros a ganar electrones y convertirse en iones negativos. Afinidad electrónica: Esta se define como la energía liberada cuando un átomo gaseoso recibe un electrón para formar un Ion negativo gaseoso por ganancia de un electrón.
- 10. Metales y no Metales: los metales tienen propiedades tales como ser buenos conductores del color y de la electricidad, tienen brillo metálico, alta densidad (generalmente). Se disuelven con otros metales formando mezclas homogéneas llamadas aleaciones por ejemplo: Cromo con acero aumenta la corrosión y la adición de carbono al hierro forma el acero. En el caso del uranio tiene número atómico de 92 y sus isótopos tienen masa atómicas de 234, 235, 236, 37 y 238. Alótropos: Cuando los átomos de un elemento se unen o se agrupan de diversas maneras entre sí, forman sustancias que aparentemente son diferentes porque se manifiestan distintas propiedades físicas, pero en realidad son la misma sustancia, ejemplos: Carbono: grafito y diamante Fósforo: forma blanca y forma roja. Oxigeno: Ozono. CONCEPTO DE MOL Y NÚMERO DE AVOGADRO Es él número de masa atómica (o peso atómico) del elemento expresado en gramos. Ejemplos: 31 16 12 C 15 P 8 O 6 16g de oxigeno 12g de carbono 31g de fósforo Ahora bien en 16g de oxigeno encontramos 6.02 X 10 23 átomos de oxigeno En 12 g de carbono tenemos 6.02 X 10 23 átomos de carbono y en 31 g de fósforo tenemos6.02 X 1023 átomos de fosforo 1023 átomos de fósforo. Entonces; 1 mol de sustancia = 6.02 X 1023 átomos, iones, partículas o moléculas. Es lo que llamamos numero de avogadro. PESO MOLECULAR O PESO FORMULA El peso formula de un compuesto se determino por la suma de los pesos atómicos de los átomos de una molécula. Con el numero de átomos y el peso atómico de cada elemento indicado por la formula. Podemos decir que es la formula que contiene el número real de átomos de cada elemento presente en una molécula del compuesto y se reporta como g/mol. Ejemplos.
- 11. H2O: H: 2x1 =2 H2SO4: H: 2x1= 2 NaHCO3: Na: 1x23= 23 Al 2 (SO 4 ) 3: Al: 2x27=54 O: 1x16=16 S: 1x32= 32 H: 1 x 1 = 1 S: 3x32 =96 O: 4X16= 64 C: 1x12= 12 O:12x16=192 186g/mol O: 3x16=48 98g/mol 342g/mol 84g/mol También decimos que; 1 mol (M) de cualquier compuesto contiene 6.02 x 10 23 moléculas; así en 18g de agua (su peso molecular) tiene 6.02 x 1023 moléculas. Densidad La posición de la masa de una sustancia, con su volumen; es decir, es la masa por unidad de volumen. D= m v Unidades en Sistema Internacional: Kg. /m 3 en CGS: gr. /cm3 Lo base patrón de diferencia es la densidad del agua. ¿Cuál es el volumen que ocupo IPGH de tetracloruro de carbono. DH2O 4ºC= 1000kg/m3 (SI) o 1g/cm2 (CGS) Sabiendo que la densidad de esta sustancia es de 1.60gr/cm3 V=m/D V=1000/1.69/cm3 V=625 cm3 Enlaces Químicos Se considero como la fuerza de unión de los átomos entre si para formar moléculas tendiendo a alcanzar la configuración de gas noble. Existen en forma general dos tipos de enlace) iónico y covalente. Calcular la densidad: de una sustancia que ocupa un volumen de 70 al y tienen una masa de 165 g D= 2.359/cm3 3 D= 165g/70cm Calcular la masa de una muestra que ocupa un volumen de 185ml de glicerina si la densidad de este es de 1.26g/ml M= v =233.1g m=DV m=(1.26g/ml) (185ml) m= 233.1g Calcular el volumen que ocupa una muestra de cloroformo que tiene una masa de 37.5g si la densidad de esta es de 1.49g/ml v = m/D =25.16ml. l) Enlace lónico de electro valencia)'. Se realizo por tomar o ceder uno o más electrones én1re los átomos que se unen. Generalmente por este tipo de
- 12. enlace se forman sales. Ejemplo: Cl Na Na Cl Formándose uno red cristalina ll) Enlace covalente o enlace atómico. Los átomos comparten entre ellos uno o mas pares de electrones Este enlace es mas evidente entre átomos de tipo gaseoso. Ejemplo: A) Cl ClL Cl Cl Cl2 B) O O O2
- 13. Por eso los gases se presentan en forma diatómica. O O NOMENCLATURA QUIMICA Se llama asi, al conjunto de reglas que se han establecido para uniformar, en lo posible los nombres de los compuestos quimicos o designación sistemática de las sustancias por medio de símbolos y expresiones determinadas; I) Iones positivos o cationes: Se mencionan con las palabras ion de y a continuación el nombre del elemento positivo. Ejemplos: Na Ion de sodio Ba2+ Ion de bario B3 ion de Boro K+ Ion de potasio Ca 2+ Ion de calcio A(3+ion de aluminio Li+ Ion de litio Sr 2+ Ion de estroncio ii) Iones negativos o aniones. Se mencionan con lo palabra Ion. Y después el nombre del elemento con el sufijo uro con excepción del elemento oxigeno. Ejemplos': Cl -1 Ion Cloruro S2 Ion Sulfuro Br -1 Ion Bromuro Te-2 Ion Telurio I -1 Ion Yoduro (loduro) C-2 Ion Carburo O2 Oxido III) Radicales o iones poli atómicos'. Son iones que están formados por dos o más átomos, pudiendo tener carga positiva o carga negativa, en donde cada uno de los átomos tiene un comportamiento diferente al que tienen en formo individual y no están nunca en forma aislado o libre. Ion como formula Nombres C2 H3 O2 -1 Ion acetato. NH4 1+ Ion amonio.
- 14. (NH 3 1+) Ion (amoniaco). HCO 3 -1 Ion bicarbonato (o carbonato ácido). C03-2 Ion carbonato. CN -1 Ion cianuro. -1 *C10 Ion hipoclorito. *CI0 2 -1 Ion clorito *CI03 -1 Ion clorato. *Cl04 -1 Ion Perclorato. CrO4 2 Ion cromato. Cr2 O7 -2 Ion dicromato. OH -1 Ion hidróxido (Hidroxilo). NO2 -1 Ion nitrito. NO3 -1 Ion nitrato. MnO4 -1 Ion permanganato. SO3 -2 Ion sulfito. SO4 -'2 Ion sulfato. H2 P04 -1 Ion dihidrógeno fosfato. HPO4 -2 Ion monohidrógeno fosfato. PO-3 Ion fosfato. El halógeno cloro puede ser sustituido por cualquiera de los otros halógenos, teniendo la misma terminación. IV) Iones de elemento de transmisión; Aquí los iones metálicos de mas bajo valencia o número de oxidación su nombre se hace terminar en oso y los de más alta valencia en ICO. Aunque existe también el nombrarlos de formo sistemático. Ejemplos; Ion nombre común nombre sistemático Ho1+ ino mercuroso Ion de mercurio Hg2+ Ion mercúrico Ion de mercurio II Fe2+ Ion ferroso Ion de fierro II Fe3+ Ion férrico Ion de fierro III *Cu1+ Ion cuproso Ion de cobre I *Cu2+ Ion cúprico Ion de cobre II */u1+ Ion auroso Ion de oro I *Au2+ Ion aúrico Ion de oro III **Sn2+ Ion estañoso Ion de estaño II **Sn 4+ Ion estanico Ion de estaño IV **Pb24 ion plumboso ion de plomo II **Pb4+ Ion plúmbico Ion de plomo IV
- 15. Concepto de ácido y base (álcalis) según Sventer Arrhenius. a) Ácido: Es una sustancia que libera iones hidrogeno, (o protones o iones hidronios) al hacer contacto con el agua, y dan coloración azul al papel rojo del tornasol. Los ácidos mas conocidos son: HCI ácido clorhídrico (gas)(diluido es ácido muriático) H2 SO4 ácido sulfúrico H2 SO3 ácido sulfuroso HNO3 ácido nítrico HNO2 ácido nitroso H2 CO3 ácido carbónico H2 S ácido sulfhídrico H3 PO4 ácido fosfórico H2 BO3 ácido bórico • HCN acido cianhídrico HClO ácido hipocloroso HCIO2 ácido cloroso HCIO3 ácido clórico HClO4 ácido perclórico CH3 COOH ácido acético (o vinagre). b) Base o álcali. Es uno sustancia que forma iones hidróxido (OH) al reaccionar con el agua. Dando coloración rojo al popel azul de tornasol. Tiene sabor amargo. Las bases más conocidas son: NaOH hidróxido de sodio KOH hidróxido de potasio Ca(OH)2 hidróxido de calcio Mg(OH)2 hidróxido de magnesio Al(OH)3 hidróxido de aluminio Fe(OH)2 hidróxido de fierro II o hidróxido ferroso Fe(OH)3 hidróxido de fierro III o hidróxido férrico -OXIDACION. En el cuerpo humano y en la vida diaria se realizan una serie de reacciones llamadas de oxidación que son esenciales para el hombre, como la respiración, cocinar, quemar combustible.
- 16. Antiguamente, el termino oxidación se aplicaba a todas aquellas reacciones donde el oxigeno se combinaba con otra sustancia; la sustancia que ganaba el oxigeno se decía que se oxidaba y la que lo perdía se consideraba que se reducía. Posteriormente, los términos oxidación y reducción se aplicaron a procesos donde hay transferencia de electrones; la sustancia que pierde electrones se dice que se oxida y la que los gana es la que se reduce. Siempre que se realiza una oxidación se produce una reducción, y viceversa, ya que se requiere que una concomitantes porque no es posible que uno se realice sin el rostro. Oxidación es la ganancia de oxigeno o perdida de electrones. Reducción es la perdida de oxigeno o ganancia de electrones. Cuando el sodio reacciona con el oxigeno se forma el óxido sodio (Na 2O) y se dice que el átomo de sodio se oxida. 4Na + O2 = 2Na2O La reacción de oxidación del potasio es: 4K + O2 –2K2O Las oxidaciones pueden ser lentas o rápidas, pero en todas ellas se liberan energía. Sin embargo, y por lo general, el termino oxidación se aplica a procesos cuyas manifestaciones son lentas y en donde la energía que se produce no se percibe por que se disipa en el ambiente, por ejemplo: la respiración, la corrosión de los metales, la putrefacción de la madera, etc. En las oxidaciones rápidas los efectos son inmediatos, claramente visibles, generan grandes cantidades de calor y en ellas, debido a la elevación de la temperatura, se puede producir la llama, a este tipo de reacción se les llama reacciones de combustión. CONCEPTO DE HIDROCARBURO. Es un compuesto orgánico formado exclusivamente por carbono e hidrógeno. Son los compuestos orgánicos mas simples y pueden ser considerados como las sustancias principales de las que se derivan todos los demás compuestos orgánicos. Los hidrocarburos se clasifican en dos grupos principales, de cadena abierta y cíclicos. En los compuesto de cadena abierta que contienen mas de un átomo de carbono, los átomos de carbono están unidos entre si formando una cadena lineal que puede tener una o mas ramificaciones. En los compuestos cíclicos, los átomos de carbono forman uno o mas anillos cerrados. Los dos grupos principales se subdividen según su comportamiento químico en saturados e insaturados. TIPOS DE HIDROCARBUROS Hidrocarburos saturados, llamados tamben alcanos, que presentan enlaces sencillos. Los alquenos, que tienen enlaces dobles y los alquinos, con enlaces triples.
- 17. VALENCIAS DEL CARBONO Y DEL HIDROGENO Recuerda que el carbono actúa con valencia 4, lo que supone que debe saturar (estar unido) a cuatro enlaces. El hidrógeno con valencia 1, por lo cual se une solo con 1 enlace. NORMAS GENERALES PARA LA FORMULACION 1. Todas las formulas llevan un prefijo y una terminación. El prefijo indica la longitud de la cadena principal de carbonos, pues dicho prefijo indica el numero de carbonos que posee esa cadena. La terminación indica el tipo de hidrocarburo, siendo “ano” para alcanos, “eno” para alquenos e “ino” para alquinos. 2. Los prefijos indicativos del numero de carnoso son: met 1 et 2 prop 3 but 4 penta 5 hexa 6 hepta 7 octa 8 nona 9 deca 10 3. En una cadena pueden existir “bifurcaciones”. Por ello, debemos elegir como cadena principal la que tenga mas átomos de carbono. Las cadenas laterales se llaman radicales y se nombran en función del numero de carbonos que tienen. Veamos los nombres de los radicales: Metil - CH3 Etil - CH2 - CH3 Propil - CH2 – CH2 – CH3 Como ves, usan el prefijo mas la terminación “il”. 4. Como los radicales pueden ir colocados en distintos carbonos, debemos indicar en que carbono están colocados. Para ellos numeramos la cadena y, al nombrar el radical, anteponemos un numero que indica en que carbono de la cadena principal esta colocado. CH3 – CH2 – CH2 – CH2 – CH – CH3 Cadena principal CH3 La cadena principal es la enmarcada. luego seria 5 metil hexano, si empiezo a contar por la derecha o 2 metil hexano, si empiezo por la izquierda. La norma dice que hay que empezar por el lado tal que los números de los radicales sean los mas bajos. Por eso seria 2 metil hexano. cuando la cadena lleva dobles o triples enlaces, también debemos de indicar en que carbono va ese doble o triple enlace, significándolo con un numero que indica el carbono anterior a ese enlace. Se aplica la misma norma de numeración, de modo que caigan las instauraciones (dobles y triples enlaces) con el numero mas bajo. Las instauraciones tienen preferencia a la hora de numerar sobre los radicales
- 18. CH3 – CH = CH – CH2 – CH - CH3 Cadena principal CH3 Este seria el 5 metil 2 hexeno, pues se numera por la izquierda, para que el doble enlace caiga con el numero mas bajo. PETROLEO Es un liquido oleoso bituminoso de origen natural compuesto por diferentes sustancias orgánicas. Se encuentra en grandes cantidades bajo la superficie terrestre y se emplea como combustible y materia prima para la industria química. El petróleo y sus derivados se emplean para fabricar medicinas, fertilizantes, productos alimenticios, objetos de plástico, materiales de construcción, pinturas o textiles y como generador de electricidad. CRACTERISTICAS Todos los tipos de petróleo se componen de hidrocarburos, aunque también suelen contener unos pocos compuestos de azufre y de oxigeno. El petróleo contiene elementos gaseosos, líquidos y sólidos. La consistencia varia desde un liquido tan poco viscoso como la gasolina hasta un liquido tan espeso que apenas fluye. Existen categorías de petróleo crudos los de tipo parafínico, los de tipo asfáltico y los de base mixta. FORMACIÓN El petróleo se forma bajo la superficie terrestre por la descomposición de organismos marinos. Los restos de animales minúsculos que viven en el mar se mezclan con las arenas y limos que caen al fondo en las cuencas marinas tranquilas. Estos depósitos, ricos en materiales orgánicos, se convierten en rocas generadoras de crudo. El proceso comenzó hace muchos millones de años, cuando surgieron los organismos vivos en grandes cantidades, y continua hasta el presente. Los sedimentos se van haciendo mas espesos y se hunden en el suelo marino bajo su propio peso. A medida que van acumulándose depósitos adicionales, la presión sobre los situados mas abajo se multiplica por varios miles, y la temperatura aumenta en varios cientos de grados. El cieno y la arena se endurecen y se convierten en exquisitos y arenisca; los carbonatos precipitados y los restos de caparazones se convierten en caliza, y los tejidos blandos de los organismos muertos se transforman en petróleo y gas natural. Una vez formado el petróleo, este fluye hacia arriba a través de la corteza terrestre por que su densidad es menor que la de las salmuersas que saturan los intersticios de los exquisitos, arenas y rocas de carbonato que constituyen dicha corteza. El petróleo y el gas natural ascienden a través de los poros microscópicos de los sedimentos situados por encima. Con frecuencia acaban encontrando un exquisito impermeable o una capa de roca densa: el petróleo queda atrapado, formando un deposito. Sin embargo, una parte significativa del petróleo no se topa con rocas impermeables sino que brota en la superficie terrestre o en el fondo del océano. Entre los depósitos superficiales también figuran los lagos bituminosos y las filtraciones de gas natural. CLASIFICACION DE LOS LÍPIDOS. Insolubles en agua solubles en disolventes no polares: cloroformo, éter, benceno. El rasgo distintivo de los lípidos es la naturaleza hidrocarbonada de la cadena principal de los mismos. Sus funciones biológicas son:
- 19. Elementos estructurales (membranas biológicas) Transporte y almacenamiento de combustible Protección (superficie de animales) Componentes de la superficie celular sirven: Reconocimiento celular. Especificidad de especies Inmunidad Ácidos grasos: Índice de yodo Triacilgliceridos Ceras Ceras: Esteroles Ácidos biliares Hormonas (andrógenos, estrógenos) Vitamina D RELACIONA LAS SIGUIENTES COLUMNAS: ( ) Hidróxido 1. H2CrO4 ( ) Peróxido 2. FeO ( ) Hidrácido 3. PbCl2 ( ) Hidruro 4. AlH3 ( ) Oxido no metálico o anhídrido 5. Ca(H2PO4)2 ( ) Sal binaria 6. Mg(NO3)2 ( ) Sal ácida 7. KOH ( ) Oxácido 8. SO2 ( ) Sal diácida 9. H2O2 ( ) Oxido metálico 10. NaHCO3 ( ) Sal neutra ternaria 11. HCl 1. KlO3 ( ) Ácido cianhídrico 2. MgSiO3 ( ) Telurato de níquel II 3. Co2(CO3)3 ( ) Ácido antimónico 4. NiTeO4 ( ) Oxalato de sodio 5. H3SbO4 ( ) Ácido fosfórico 6. H3PO4 ( ) Silicato de magnesio 7. Sn(OH)2 ( ) Carbonato de cobalto II 8. Sr(ClO)2 ( ) Yodato de potasio 9. PbO ( ) Sulfuro de aluminio 10. Al2S3 ( ) Hidróxido de estaño 11. Na2C2O4 ( ) Oxido de plomo 12. HCN ( ) Hipoclorito de estroncio
- 20. MODELOS DE REACCIONES QUIMICAS INORGÁNICAS METAL + OXIGENO = OXIDO METALICO 4Na + O2= 2 Na2O OXIDO DE SODIO Cualquier metal que reaccione con el oxigeno, produce el óxido metálico espondiente, también conocido como óxido básico. NO METAL + OXIGENO = OXIDO METALICO Cl2 + O2 = Cl2O MONÓXIDO DE DICLORO Cl2 + O2 = Cl2O3 TRIOXIDO DE DICLORO Los no metales, en su mayoría gases, a excepción del bromo que es líquido, al reaccionar con el oxigeno forman los llamados óxidos no metálicos u óxidos ácidos. METAL ACTIVO + AGUA = HIDRÓXIDO + HIDRÓGENO (SUBE) ↑ 2Na + 2H2O = 2NaOH + H2 HIDROXIDO DE SODIO + HIDRÓGENO QUE SE DESPRENDE. El metal activo los elementos de los grupos I-A y II-A a excepción del magnesio, los cuales reaccionan energéticamente con el agua para dar como producto el hidróxido o base correspondiente acompañado de desprendimiento de hidrógeno en forma de gas. OXIDO METALICO + AGUA = HIDRÓXIDO Li2O + H2O = 2LiOH HIDRÓXIDO DE LITIO FeO + H2O = Fe (OH)2 HIDRÓXIDO DE HIERRO (II) METAL + HIDRÓGENO = HIDRURO 2K + H2 = 2KH HIDRURO DE POTASIO NO METAL + HIDRÓGENO = HIDRACIDO Cl2 + H2 = 2HCl ACIDO CLORHÍDRICO Cuando los no metales reaccionan con el hidrógeno, forman los llamados hidrácido Excepciones: N2 + 3H2 = 2NH3 AMONIACO O2 + 2H2 = 2H2O AGUA C + 2H2 = CH4 METANO METAL + NO METAL = SAL BINARIA 2Li +Cl2 = 2LiCl CLORURO DE LITIO OXIDO NO METALICO + AGUA = OXIACIDO Cl2O + H2O = 2HclO ACIDO HIPOCLOROSO
- 21. Cl2O5 + H2O = HclO3 ACIDO CLÓRICO N2O3 + H2O = HNO2 ACIDO NITROSO ACIDO + HIIDROXIDO = SAL + AGUA HNO3 + AgOH = AgNO3 + H2O NITRATO DE PLATA CON AGUA También conocida como neutralización, el tipo de sal producida va a depender del tipo de ácido utilizado, es decir, se emplea un hidrácido se obtendrá una sal binaria, si se adiciona un oxiácido, se obtendrá una oxisal. METAL + ACIDO = SAL + HIDRÓGENO (SUBE) ↑ 2Na + 2HCl = 2NaCl + H2 CLORURO DE SODIO CON DESPRENDIMIENTO DE HIDRÓGENO Ba + 2HI =Bal +H2 HIODURO DE BARIO CON DESPRENDIMIENTO DE HIDRÓGENO El tipo de sal dependerá del tipo de ácido, al tener un axiácido se producirá una oxisal, teniendo desprendimiento de hidrógeno gaseoso. FUNCION QUÍMICA Y GRUPO FUNCIONAL Llamamos función química al conjunto de propiedades comunes a una serie de compuestos análogos o semejantes. Se considera como grupo funcional a un átomo o conjunto de átomos que son los responsables del carácter químico de la molécula a la que pertenecen.
- 22. Grupo Función Química funcional. Hidruros H-1 Metal y no metal con el hidrógeno para nombrarlo se emplee la palabra hidruro, se agrega la preposición “de” y se termina con el nombre del metal que participa. Ejemplo: Hidruro de aluminio Al + 3H-1 = AlH-3 Escribiéndose el metal del lado izquierdo y el ion hidruro del lado derecho. Es recomendable escribir los números de oxidación de cada elemento, si los números son iguales, la formula se escribe indicando el símbolo de cada uno, pero si no coinciden, es decir, son diferentes, se intercambian los subíndices, de tal manera que la formula resultante sea eléctricamente neutra. Óxidos O-2 Aquellos compuestos que tienen en su grupo funcional O-2 , existiendo dos tipos: óxidos metálicos o básicos (metal + oxigeno, lado derecho grupo funcional y del lado izquierdo el metal que participe; el nombre se realiza empleando la palabra óxido, se agrega la preposición “de” y se termina con el nombre del metal que participa, para los metales con mas de un numero de oxidación, se agrega un numero romano al final; y la segunda se le agrega un icono para el mayor numero de oxidación y un oso para el menor). Y los no metálicos o anhídridos, llamados también óxidos ácidos, lado derecho grupo funcional, lado izquierdo el no metal que participe. Ácidos H+1 H1 pudieron ser: los que no contienen en su estructura oxigeno llamados hidrácidos, (hidrógeno y un no metal, parte izquierda el hidrógeno y lado derecho no metal; se nombran anteponiendo la palabra ácido y el nombre del no metal teniendo la terminación hídrico) Y los que si contienen oxigeno llamados oxiácidos, contienen 3 elementos, en la parte central un no metal, hidrógeno del lado izquierdo y oxigeno del derecho, para el nombre, se emplea la palabra ácido, se completa el nombre con el átomo central, considerando las terminaciones y prefijos ya estudiados: hipo-oso, oso, ico y per-ico, según el número de oxidación del átomo central. Sales Ac-1 Se derivan de un ácido al sustituir uno o mas hidrógenos por metales, y de acuerdo con eso, si el ácido tiene un hidrógeno; será sal neutra; si tiene dos formara sales ácidas y neutras, si tiene 3 formará sales diácidas, ácidas o neutras. Metal lado izquierdo, del lado derecho el ion negativo que procede de un ácido al eliminar los hidrógenos necesarios. El nombre será; el que corresponda al ion negativo que procede de un ácido, se agrega la preposición “de” y terminar con el nombre del metal que participa. Hidróxidos (OH)-1 (OH) –1, grupo funcional del lado derecho y el metal del lado izquierdo, para nombrarlos se emplea la palabra hidróxido, se agrega la preposición “de” y se termina con el metal participante. Peróxidos O-1 Compuestos con grupo funcional O-1 es la unión de dicho grupo funcional con algunos metales; se escribe del lado izquierdo el metal y del lado derecho el grupo funcional con sus respectivos números de oxidación y cruzarlos de ser necesario. Ejemplo: Na + 12O-12 Peroxido de sodio.
- 23. Ejercicios de nomenclatura: Cloruro de sodio: Na+ Cl NaCl Ca + -F Fluoruro de calcio: Ca++ F +-F CaF2 F Al + - OH Hidróxido de aluminio: Alee + OH + -OH Al(OH)3 + -OH AL(OH)3 + + - OH - OH Sulfato de sodio: Na+-- SO4 Na + - Na Na + - SO4 Fosfato de Bario-. Ba PO4- --> Ba3 (P04)2 Ba+- PO4 Ba. PO4 +- PO4 + Ba Ba+ Ba(Po4)2 + Ba + Sulfato de Aluminio: Al+++ SO4 Al2 (S04)3 Al+++ SO4 += SO4 + Al + = SO4 + Al2(SO4)3 SO4 Al + SO4 + = Otra forma de entender lo unión es relacionando las valencias en forma cruzada. Ejemplos: Cloruro de Calcio Ca2+ Cl-1 —> CaCl2 Fosfato de Sodio Na1+ Po -3 4 –Na3 PO4 Hidróxido de Magnesio Mg2+ OH -1 — Mg(OH)2
- 24. Dicromato de Potasio K1+Cr2 O7 -2 2 —> K2 CrzO7 Bicarbonato de Boro B3 HCO3-1+-—> B(HC03)3 Sulfato de Aluminio Al3+ (SO4 ) -2 2 Al2(SO4)3 Reacciones Químicas. El proceso en virtud del cual se convierte ose transforme en una o varias sustancias químicas en otras distintas de las distintas de las primeras. Una reacción química se presenta por medio de una ecuación química una manera abreviado de expresar un cambio con símbolo y fórmulas, pero para considerarla correcta debe estar balanceada, es decir, que se cumpla la Ley de la conservación de la materia de A. L. Lavoisier, es decir, la cantidad de átomos o moles de átomos de cada elemento será igual en ambos lados de lo ecuación (reactantes y productos). En ocasiones es necesario agregar un catalizador paro que se lleve acabo dicho reacción; entendiendo como catalizador: aquellas sustancias que modifican la velocidad de reacción, cero no el equilibrio de la misma. En otras ocasiones es necesario, a nivel laboratorio agregar un indicador para demostrar la presencia ó el producto deseado. Sabiendo que un indicador es: Sustancias orgánicas que tiñen de color distinto en medio ácido o en medio básico, es decir, principalmente en reacciones de neutralización. Recordamos:Metales No Metales O (oxígeno) Óxidos Anhídridos H2O Hidróxidos Ácidos (oxiácidos)
- 25. Sal y Agua (reacción de neutralización). Las reacciones químicas son de cuatro tipos. i) De combinación (o adición). A + Z ——> AZ ¡i) De descomposición (o análisis): AZ ————> A + Z iii) De sustitución'. A + BZ ____^ AZ + B iv) De doble sustitución". AX + BZ ———> AZ + BX Se puede ejemplificar i) 2Hg + Oz———-2Hc O S+ O———-SO-1 ii)2HgO—-2Hg+ Oz 2KC103———2KCl+ 302 iii)Fe + CuS04 —— FeS04 + Cu Zn+2AgN03 —— Zn (N03 )2 + 2Ag
- 26. Breve semblanza de Química Orgánica. Compuestos orgánicos se llaman así debido a que antes se pensaba que sólo se originaban o partir de materia orgánica, es decir de organismos. Aunque hoy sabemos que no se cumple en toda su totalidad. El elemento principal en toda su totalidad. El elemento principal en todos los compuestos orgánicos es el Carbono (Pero no el CaCO3, ni el KCN). Los hidrocarburos compuestos formados por "C" e "H", se utilizan como combustible para los medios de transporte y para el calentamiento de los hogares. Por ser tetravalente, pueden formar cuatro enlaces siendo simples, dobles y triples. Alcanos: Son los hidrocarburos más simples, y cumplen la formula general para cuando son de cadena abierta CnH2n; siendo los ejemplos más representativos: Fórmula Fórmula sumí desarrollada nombre CH4 metano C2 H6 CH3 - CH3 etano C3 H8 CH3 –CH2 – CH3 propano C4 H10 CH3 -CH2 - CH2 - CH3 butano C5 H12 CH3 –CH2 – CH2 – CH2 – CH3 pentano C6 H14 CH2-CH2- CH2- CH2- CH2 -CH3 hexano Alquenos'- Son hidrocarburos que contienen un doble enlace. Se dice que son insaturados. Para los de cadena abierta su formula general es: C nH2n, ejemplos: Fórmula nombre CH2 =CH2 eteno
- 27. CH2 =CH-CH3 propeno CH2 =CH-CH2 -CH3 buteno CH3 -CH=CH – CH2 –CH3 penteno CH3 -CH=CH-CH2 -CH2 -CH3 Hexeno Alquinos: Son hidrocarburos que contienen por lo menos un triple enlace. La formula general para los alquinos de cadena abierta es; CnH 2n-2. Fórmula nombre CH ≡ CH etino CH≡ C – CH3 propino CH≡ C – CH2 –CH3 butino CH≡ C – CH2 – CH2 – CH3 pentino CH3 – C ≡ C – CH2 – CH2 – CH3 Hexino Grupos funcionales orgánicos: Nombre Fórmula general Ejemplo Alcoholes R-OH CH3 –CH2 -OH etano Éteres R- O – R CH3 – O – CH3 dimetileter Aminas R-NH2 CH3 -NH2 metilamina O O ║ ║ Haldeados R-C-H CH etal de hidroetano O O ║ ║ Cetonas R-C-R CH3 -C-CH3 acetona O O ║ ║ acido Ácidos Carboilulicos R-C-OH CH3 -CH2 -C-OH propanoico
- 28. O O ║ ║ etil Éteres R-C-OR CH3 - C-O-CH 2 -CH3 etanoato O O ║ ║ Amidas R-C-NH2 CH3 -C- NH2 etonamida MADERA SÓLIDOS CARBON MINERAL CARBON VEGETAL GASOLINA PETROLEO Y SUS DISEL LIQUIDOS DERIVADOS ASFALATO COMBUSTIBLES ALCOHOL GAS NATURAL GAS BUTANO GASEOSOS DE HULLA METANO ACETILENO Fuente principal de compuestos orgánicos, el petróleo y el carbón mineral. Los combustibles son compuestos orgánicos que poseen carbono indispensable en su composición. QUIMICA ORGANICA O DEL CARBONO El carbono en su ultimo nivel tiene 4 electrones 4 en laces covalentes, que forma consigo mismo y con otros elementos. Gran facilidad para enlazarse actualmente se conocen 4 millones aprox de compuestos orgánicos( los inorgánicos son 100mil aprox. ). Características de componentes orgánicos. - contienen carbono en su molécula - masa molecular muy elevada
- 29. - puntos de fusión y de ebullición bajos 300º C aprox. - Se disuelven fácilmente en sustancias orgánicas (alcohol, éter, benceno, etc). - Los que son combustibles se descompones al calentarlos a temperatura alta (plásticas, polietileno, etc.). │ │ │ SENCILLAS ─ C ─ ─C ─C ─ TIPOS DE │ │ │ ENLACES O (LIGADURAS) │ │ DOBLES ─ C ═C ─C ─ │ │ │ │ TRIPLES ─ C ≡ C ─C ─ │ │ TIPOS DE CADENAS │ │ │ │ Sencillas Abiertas (lineales o aciclicas) ─ C ─C ─C ─C Ramificada │ │ │ │ │ │ │ Ramificadas (arborescentes) ─ C ─C ─C ─ │ ─ C─ │ │ C / Cíclicas (cerradas) ─ C ─C ─ Homocíclicas │ │ Heterocíclicas │ │ Saturadas ─C ─C ─
- 30. │ │ │ │ Dobles o No saturadas ─ C ═ C ─ ─ C ≡ C ─ triples │ │ │ │ Sencillas ─ C ─C ─C ─C─ │ │ │ │ │ ─C ─ │ │ │ Ramificadas ─ C ─C ─C ═ C─ C ─ │ │ │ │ │ │ │ Homiciclicos ─ C ─C ─ (Solo átomos de C) │ │ ─ C ─C ─ │ │ ║ C Heterociclicos / (contienen algun otro elemento) ═ C C ═ ═ C C ═ / N │ │ │ Desarrollada o empirica ─ C ─C ─ │ │ │ │ │ ─ C ─C ═ C ─ C ─C─ │ │ │ │ │ ─ C ─C ─C ─ │ ─ C─ │
- 31. FORMULAS Estructural o semidesarrollada CH3 -CH-CH3 CH3 -CH═CH-CH2 –CH3 Indica cada atomo de C con el Nº I De atomos de H con que se enlaza OH CH3-CH-CH3 I CH3 Molecular o Condensada En esta se representa al Nº de átomos de cada elemento que interviene en la CH 4 C4 H10 C5 H10 molécula del compuesto HIDROCARBUROS Sustancias que contienen carbono y son combustibles. Al quemarse producen agua, dióxido de carbono y liberan mucha energía. Compuestos constituidos por átomos de C y H PROPIEDADES Abundan en la naturaleza- petróleo, gas natural y carbón. Los átomos de C se unen entre si con enlaces sencillos, dobles o triples Alcanos – enlace simple Alifaticos Alquenos – enlace doble Alquinos – enlace triple CLASIFICACION Benceno – enlace de anillo Aromaticos y derivados o cadena cerrada
- 32. Alcanos: Son los hidrocarburos simples ya que solo contienen C e H Se encuentran en el gas natural y en el petróleo Forman cadenas abiertas y cerradas que pueden ser simples o ramificadas. Formula General Cn H2 n+2 Sirve para calcular el numero C = átomo de C de átomos de H que tiene un n = numero de átomos de C Alcano H = átomos de H Prob: Cuantos átomos de ÇH tiene un alcano que posee 16 átomos de C (hexadecano) Si n =16 Cn H 2n+ = C16 H2(16)+2 = C16 H3 4 Por lo tanto el Hexadecano tiene 34 átomos de H Los nombres que se han conservado son: Metano – CH4 Etano – C2 H6 Propano – C3 H8 Butano – C4 H10 FORMULA FORMULA ESTRUCT FORMULA CONDENSADA DESARROLLADA CH4 H METANO CH4 I H-C-H I H H H ETANO C2 H6 CH3 -CH3 I I H-C-C-H I I H H H HH PROPANO C3 H8 CH3-CH2-CH3 I I I H-C-C-C-H I I I H HH HHH H
- 33. BUTANO C4 H10 CH3-CH2-CH2-CH3 I I I I H-C-C-C-C-H I I I I HHH H HHH HH PENTANO C5 H12 CH3-CH2-CH2-CH2-CH3 I I I I I H-C-C-C-C-C-H I I I I I HHH H H PREFIJO NUMERAL TERMINACION HEXA – C6 H14 HEPTA – C7 H16 OCTA – C8 H 18 NONA – C9 H20 DECA – C10 H22 UN DECANO – C11 H24 DODECANO – C12 H26 TRIDECANO ETC… EICOSANO – C20 H42 TRICONTANO – C30 H 62 RADIACLES ALQUILO : Se forman al quitar un átomo de H a un alcano saturado. Su nombre se deriva de los cambios de la terminación ano por il o ilo.
- 34. ALQUENOS: Hidrocarburos que contienen por lo menos un enlace doble. Su nombre es combinado la terminación ano por eno. FORMULA GENERAL Cn H 2 n C = átomo del C n = Nº átomos de C H = átomos del H ETENO O CH2 = CH2 C2 H4 H H ETILENO l l CH2 = CH- CH3 C3 H4 C= C PROPENO l l CH2 = CH-CH2-CH3 H H BUTENO C4 H8 PENTENO CH2 = CH- CH2- CH- C5 H10 CH3 ALQUINOS O ASETILENICO: Hidrocarburos que xxxxx por lo menos un triple enlace. Su nombre es cambiado la terminación eno por ino. FORMULA GENERAL CnH 2n-2 C= Atomos del C N = Nº atomos de C H = Atomos de H ETANO- CH 3 – CH3- C2 H6 – C2 H 2x2-2= C2 H2 PROPANO – CH 3 CH 2 - CH 3 - C 3 H 8 - C 3 H 8x2-2 = - C 3 H 4 BUTANO – CH 3- CH 2 - CH 2 - CH 3- C4 H 10 – C4 H 4X2-2 = - C4 H 6 PENTANO - CH 3- CH 2 - CH 2 - CH 2- CH3 – C5 H 5X2-2 = - C4 H 6
