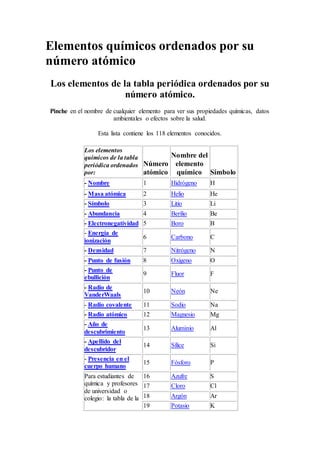
Elementos químicos ordenados por su número atómico
- 1. Elementos químicos ordenados por su número atómico Los elementos de la tabla periódica ordenados por su número atómico. Pinche en el nombre de cualquier elemento para ver sus propiedades químicas, datos ambientales o efectos sobre la salud. Esta lista contiene los 118 elementos conocidos. Los elementos químicos de la tabla periódica ordenados por: Número atómico Nombre del elemento químico Símbolo - Nombre 1 Hidrógeno H - Masa atómica 2 Helio He - Símbolo 3 Litio Li - Abundancia 4 Berilio Be - Electronegatividad 5 Boro B - Energía de ionización 6 Carbono C - Densidad 7 Nitrógeno N - Punto de fusión 8 Oxígeno O - Punto de ebullición 9 Fluor F - Radio de VanderWaals 10 Neón Ne - Radio covalente 11 Sodio Na - Radio atómico 12 Magnesio Mg - Año de descubrimiento 13 Aluminio Al - Apellido del descubridor 14 Sílice Si - Presencia en el cuerpo humano 15 Fósforo P Para estudiantes de química y profesores de universidad o colegio: la tabla de la 16 Azufre S 17 Cloro Cl 18 Argón Ar 19 Potasio K
- 2. derecha muestra una lista de los elementos ordenados por su número atómico. El elemento de mayor número atómico es el Ununoctio, y el de menor el Hidrógeno. El número atómico no tiene unidad. Por favor tenga en cuenta que los elementos no muestran su relación natural entre unos y otros tal y como ocurre en el sistema periódico. Pinche aquí para visitar nuestra tabla periódica y así obtener más información acerca de los metales, semi- conductor(es), no metal(es), gas(es) noble(s) inerte(s), halógenos, lantánidos, actínidos (elementos de tierras raras) y metales de transición. 20 Calcio Ca 21 Escandio Sc 22 Titanio Ti 23 Vanadio V 24 Cromo Cr 25 Manganeso Mn 26 Hierro Fe 27 Cobalto Co 28 Níquel Ni 29 Cobre Cu 30 Zinc Zn 31 Galio Ga 32 Germanio Ge 33 Arsénico As 34 Selenio Se 35 Bromo Br 36 Kryptón Kr 37 Rubidio Rb 38 Estroncio Sr 39 Itrio Y 40 Zirconio Zr
- 3. 41 Niobio Nb 42 Molibdeno Mo 43 Tecnecio Tc 44 Rutenio Ru 45 Rodio Rh 46 Paladio Pd 47 Plata Ag 48 Cadmio Cd 49 Indio In 50 Estaño Sn 51 Antimonio Sb 52 Teluro Te 53 Iodo I 54 Xenón Xe 55 Cesio Cs 56 Bario Ba 57 Lantano La 58 Cerio Ce 59 Praseodimio Pr 60 Neodimio Nd 61 Promecio Pm 62 Samario Sm 63 Europio Eu 64 Gadolinio Gd 65 Terbio Tb 66 Disprosio Dy 67 Holmio Ho 68 Erbio Er 69 Tulio Tm 70 Iterbio Yb 71 Lutecio Lu 72 Hafnio Hf 73 Tantalio Ta 74 Wolframio W 75 Renio Re 76 Osmio Os 77 Iridio Ir
- 4. 78 Platino Pt 79 Oro Au 80 Mercurio Hg 81 Talio Tl 82 Plomo Pb 83 Bismuto Bi 84 Polonio Po 85 Ástato At 86 Radón Rn 87 Francio Fr 88 Radio Ra 89 Actinio Ac 90 Torio Th 91 Protactinio Pa 92 Uranio U 93 Neptunio Np 94 Plutonio Pu 95 Americio Am 96 Curio Cm 97 Berkelio Bk 98 Californio Cf 99 Einstenio Es 100 Fermio Fm 101 Mendelevio Md 102 Nobelio No 103 Lawrencio Lr 104 Rutherfordio Rf 105 Dubnio Db 106 Seaborgio Sg 107 Bohrio Bh 108 Hassio Hs 109 Meitnerio Mt 110 Darmstadio Ds 111 Ununio Uuu 112 Ununbio Uub 113 Ununtrio Uut 114 Ununquadio Uuq
- 5. 115 Ununpentio Uup 116 Ununhexio Uuh 117 Ununseptio Uus 118 Ununoctio Uuo Pinche aquí: para una visión esquemática de la tabla periódica de los elementos. Read more: http://www.lenntech.es/periodica/numero/n%EF%BF%BDmero- atomico.htm#ixzz3c9DuLTFs Isótopos, número atómico y número másico | Inicio | Tutorial anterior | Tutorial posterior | Ejercicios| Los átomos están formados por un núcleo (formado por protones y neutrones), de tamaño reducido y cargado positivamente, rodeado por una nube de electrones, que se encuentran en la corteza. El número de protones que existen en el núcleo, es igual al número de electrones que lo rodean. Este número es un entero, que se denomina número atómico y se designa por la letra, "Z". La suma del número de protones y neutrones en el núcleo se denomina número másico del átomo y se designa por la letra, "A". El número de neutrones de un elemento químico se puede calcular como A-Z, es decir, como la diferencia entre el número másico y el número atómico. No todos los átomos de un elemento dado tienen la misma masa. La mayoría de los elementos tiene dos ó más isótopos, átomos que tienen el mismo número atómico, pero diferente número másico. Por lo tanto la diferencia entre dos isótopos de un elemento es el número de neutrones en el núcleo. En un elemento natural, la abundancia relativa de sus isótopos
- 6. en la naturaleza recibe el nombre de abundancia isotópica natural. La denominada masa atómica de un elemento es una media de las masas de sus isotópos naturales ponderada de acuerdo a su abundancia relativa. A = masa atómica del elemento natural Ai = masa atómica de cada isótopo xi = porcentaje de cada isótopo en la mezcla La nube de carga electrónica constituye casi todo el volumen del átomo, pero, sólo representa una pequeña parte de su masa. Los electrones, particularmente la masa externa determinan la mayoría de las propiedades mecánicas, eléctricas, químicas, etc., de los átomos, y así, un conocimiento básico de estructura atómica es importante en el estudio básico de los materiales de ingeniería. Veamos una serie de ejemplos Para el carbono Z=6. Es decir, todos los átomos de carbono tienen 6 protones y 6 electrones. El carbono tiene dos isótopos: uno con A=12, con 6 neutrones y otro con número másico 13 (7 neutrones), que se representan como: El carbono con número másico 12 es el más común (~99% de todo el carbono). Al otro isótopo se le denomina carbono-13. El hidrógeno presenta tres isótopos, y en este caso particular cada uno tiene un nombre diferente hidrógeno deuterio tritio La forma más común es el hidrógeno, que es el único átomo que no tiene neutrones en su núcleo.
- 7. Otro ejemplo son los dos isótopos más comunes del uranio: los cuales se denominan uranio-235 y uranio-238. En general las propiedades químicas de un elemento están determinadas fundamentalmente por los protones y electrones de sus átomos y en condiciones normales los neutrones no participan en los cambios químicos. Por ello los isótopos de un elemento tendrán un comportamiento químico similar, formarán el mismo tipo de compuestos y reaccionarán de manera semejante. Masa atómica La masa atómica relativa de un elemento, es la masa en gramos de 6.02 ·1023 átomos (número de Avogadro, NA) de ese elemento, la masa relativa de los elementos de la tabla periódica desde el 1 hasta el 105 esta situada en la parte inferior de los símbolos de dichos elementos. El átomo de carbono, con 6 protones y 6 neutrones, es el átomo de carbono 12 y es la masa de referencia para las masas atómicas. Una unidad de masa atómica (u.m.a), se define exactamente como 1/12 de la masa de un átomo de carbono que tiene una masa 12 u.m.a. una masa atómica relativa molar de carbono 12 tiene una masa de 12 g en esta escala. Un mol gramo (abreviado, mol) de un elemento se define como el numero en gramos de ese elemento igual al número que expresa su masa relativa molar. Así, por ejemplo, un mol gramo de aluminio tiene una masa de 26.98 g y contiene 6.023 ·1023 átomos. Veamos unos ejercicios de aplicación: La plata natural está constituida por una mezcla de dos isótopos de números másicos 107 y 109. Sabiendo que abundancia isotópica es la siguiente: 107Ag =56% y 109Ag =44%. Deducir el peso atómico de la plata natural.
- 8. Determinar la masa atómica del galio, sabiendo que existen dos isótopos 69Ga y 71Ga, cuya abundancia relativa es, respectivamente, 60,2% y 39,8%. Indica la composición de los núcleos de ambos isótopos sabiendo que el número atómico del galio es 31. Masa atómica = 69 · 0,602 + 71 · 0,398 = 69,7 u Núcleo del 69 31Ga: 31 protones y 38 neutrones (69 - 31) Núcleo del 71 31Ga: 31 protones y 40 neutrones (71 - 31). 4.1 EL NÚMERO ATÓMICO Y EL NÚMERO MÁSICO La identidad de un átomo y sus propiedades vienen dadas por el número de partículas que contiene. Lo que distingue a unos elementos químicos de otros es el número de protones que tienen sus átomos en el núcleo. Este número se llama Número atómico y se representa con la letra Z. Se coloca como subíndice a la izquierda del símbolo del elemento correspondiente. Por ejemplo, todos los átomos del elemento Hidrógeno tienen 1 protón y su Z = 1, los de helio tienen 2 protones y Z =2, los de litio, 3 protones y Z = 3,… Si el átomo es neutro, el número de electrones coincide con el de protones y nos lo da Z. El Número másico nos indica el número total de partículas que hay en el núcleo, es decir, la suma de protones y neutrones. Se representa con la letra A y se sitúa como superíndice a la izquierda del símbolo del elemento. Representa la masa del átomo medida en uma, ya que la de los electrones es tan pequeña que puede despreciarse. En el ejemplo, tendríamos un átomo del elemento neón, con 10 protones en su núcleo y 10 electrones en su corteza (es neutro). Tendría también: 22-10 = 12 neutrones. 4.2 REPRESENTACIÓN DE IONES Un ion se representa mediante el símbolo del elemento del que procede, con un superíndice a la derecha, que indica la carga que posee mediante un número y el signo + o el signo -. Los cationes han perdido electrones en el número que indica la carga positiva. Por Este átomo corresponde al elemento Aluminio. Tiene 13 protones y 14 neutrones. Es un catión con carga +3, lo
- 9. ejemplo, +3 indicará que ese átomo ha perdido 3 electrones. Los aniones han ganado electrones, en el número que indica la carga negativa. Por ejemplo, -2 indicará que ese átomo ha ganado 2 electrones. En esta escena puedes determinar las distintas partículas subatómicas de una especie atómica: que quiere decir que ha perdido 3 electrones respecto a su estado neutro; por tanto, tiene 13-3 = 10 electrones. 5.1 ISÓTOPOS Todos los átomos de un elemento químico tienen el mismo número de protones, pero pueden diferenciarse en el número de neutrones. Se llaman Isótopos los átomos que tienen el mismo número de protones y se diferencian en el número de neutrones. Por tanto, presentan el mismo número atómico (Z) y diferente número másico (A). Los isótopos tienen masa diferente, ya que Hidrógeno-1. Este isótopo tiene: 1 protón, 1 electrón y 0 neutrones. Hidrógeno-2. Este isótopo tiene: 1 protón, 1 electrón y 1 neutrón. Hidrógeno-3. Este isótopo tiene: 1 protón, 1 electrón y 2 neutrones.
- 10. tienen distinto número de neutrones. Para nombrarlos se indica su nombre seguido de su número másico; por ejemplo, sodio- 23 (Na-23). LEMENTOS: NUMEROS Y PESOS ATOMICOS ORDENADOS ALFABETICAMENTE Referencia : Selected Values of Properties of Hydrocarbons and Related Compounds. American Petroleum Institute, Research Project 44, Texas A & M University, College Station, Texas, June 1972. A B C D E F G H I K L M N O P R S T U V X Y Z Página principal ELEMENTO SIMBOLO NUMERO ATOMICO PESO ATOMICO Actinio Ac 89 Aluminio Al 13 26,98154 Americio Am 95 Antimonio Sb 51 121,75 Argón Ar 18 39,948 Arsénico As 33 74,9216 Astato At 85 Azufre S 16 32,06 Bario Ba 56 137,34 Berilio Be 4 9,01218 Berkelio Bk 97 Bismuto Bi 83 208,9804 Boro B 5 10,81 Bromo Br 35 79,904 Cadmio Cd 48 112,40 Calcio Ca 20 40,08 Californio Cf 98 Carbono C 6 12,011 Carbono 12C 6 12 (exactamente) Cerio Ce 58 140,12 Cesio Cs 55 132,9054 Cloro Cl 17 35,453 Cobalto Co 27 58,9332 Cobre Cu 29 63,546 Cromo Cr 24 51,996
- 11. Curio Cm 96 Disprosio Dy 66 162,50 Einstenio Es 99 Erbio Er 68 167,26 Escandio Sc 21 44,9559 Estaño Sn 50 118,69 Estroncio Sr 38 87,62 Europio Eu 63 151,96 Fermio Fm 100 Fierro Fe 26 55,847 Fluor F 9 18,99840 Fósforo P 15 30,97376 Francio Fr 87 Gadolinio Gd 64 157,25 Galio Ga 31 69,72 Germanio Ge 32 72,59 Hafnio Hf 72 178,49 Helio He 2 4,00260 Hidrógeno H 1 1,0079 Holmio Ho 67 164,9304 Indio In 49 114,82 Iridio Ir 77 192,22 Iterbio Yb 70 173,04 Itrio Y 39 88,9059 Kriptón Kr 36 83,80 Lantano La 57 138,9055 Lawrencio Lw 103 Litio Li 3 6,941 Lutecio Lu 71 174,97 Magnesio Mg 12 24,305 Manganeso Mn 25 54,9380 Mendelevio Md 101 Mercurio Hg 80 200,59 Molibdeno Mo 42 95,94 Neodimio Nd 60 144,24 Neón Ne 10 20,179 Neptunio Np 93 237,0482 Niobio Nb 41 92,9064 Níquel Ni 28 58,71 Nitrógeno N 7 14,0067 Nobelio No 102 Oro Au 79 196,9665 Osmio Os 72 190,2 Oxígeno O 8 15,9994
- 12. Paladio Pd 46 106,4 Plata Ag 47 107,868 Platino Pt 78 195,09 Plomo Pb 82 207,2 Plutonio Pu 94 Polonio Po 84 Potasio K 19 39,098 Praseodimio Pr 59 140,9077 Prometio Pm 61 Protactinio Pa 91 231,0359 Radio Ra 88 226,0254 Radón Rn 86 Renio Re 75 186,2 Rodio Rh 45 102,9055 Rubidio Rb 37 85,4678 Rutenio Ru 44 101,07 Samario Sm 62 150,4 Selenio Se 34 78,96 Silicio Si 14 28,086 Sodio Na 11 22,98977 Talio Tl 81 204,37 Tántalo Ta 73 180,9479 Tecnecio Tc 43 98,9062 Teluro Te 52 127,60 Terbio Tb 65 158,9254 Titanio Ti 22 47,90 Torio Th 90 232,0381 Tulio Tm 69 168,9342 Tungsteno W 74 183,85 Uranio U 92 238,029 Vanadio V 23 50,9414 Xenón Xe 54 131,30 Yodo I 53 126,9045 Zinc Zn 30 65,38 Zirconio Zr 40 91,22