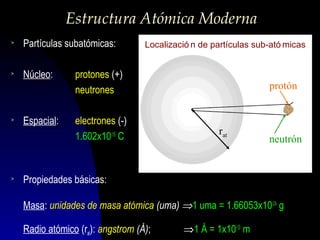
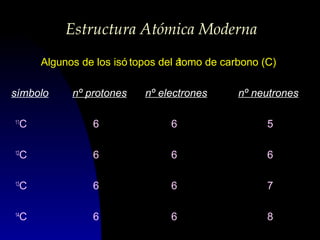
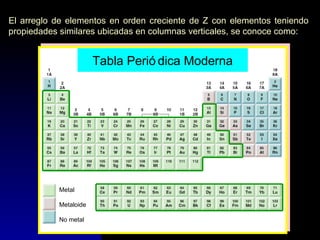
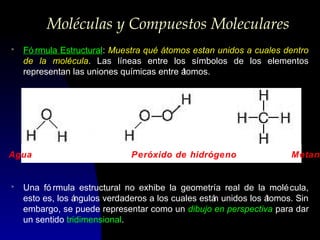
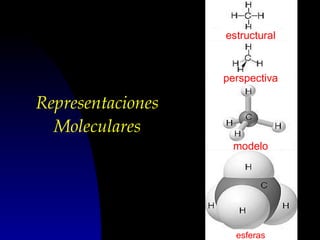
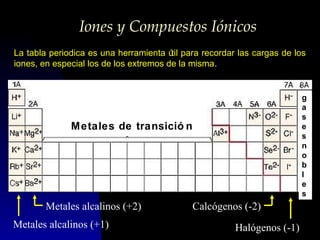
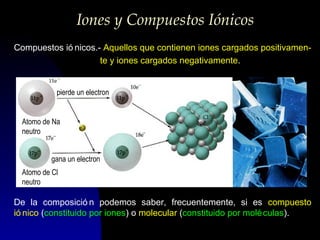
Este documento describe la estructura atómica moderna, incluyendo las partículas subatómicas como protones, neutrones y electrones. Explica la localización de estas partículas dentro del núcleo y alrededor del átomo. También describe moléculas, compuestos moleculares, iones y compuestos iónicos, así como la tabla periódica y cómo esta muestra las propiedades periódicas de los elementos.