Dinamica de gases guia 1
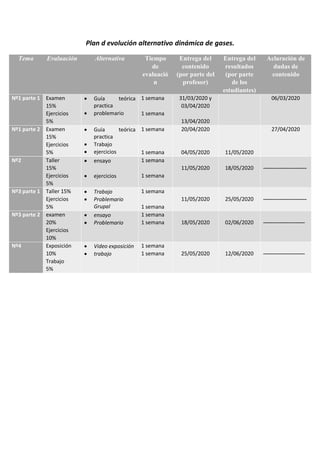
- 1. Plan d evolución alternativo dinámica de gases. Tema Evaluación Alternativa Tiempo de evaluació n Entrega del contenido (por parte del profesor) Entrega del resultados (por parte de los estudiantes) Aclaración de dudas de contenido Nº1 parte 1 Examen 15% Ejercicios 5% Guía teórica practica problemario 1 semana 1 semana 31/03/2020 y 03/04/2020 13/04/2020 06/03/2020 Nº1 parte 2 Examen 15% Ejercicios 5% Guía teórica practica Trabajo ejercicios 1 semana 1 semana 20/04/2020 04/05/2020 11/05/2020 27/04/2020 Nº2 Taller 15% Ejercicios 5% ensayo ejercicios 1 semana 1 semana 11/05/2020 18/05/2020 ------------------------ Nº3 parte 1 Taller 15% Ejercicios 5% Trabajo Problemario Grupal 1 semana 1 semana 11/05/2020 25/05/2020 ------------------------ Nº3 parte 2 examen 20% Ejercicios 10% ensayo Problemario 1 semana 1 semana 18/05/2020 02/06/2020 ----------------------- Nº4 Exposición 10% Trabajo 5% Video exposición trabajo 1 semana 1 semana 25/05/2020 12/06/2020 -----------------------
- 2. Guía dinámica de gases tema Nº1 parte 1 En clase se abarco los aspectos básicos de los gases ideales mediante el estudio de su comportamiento con el uso de las ecuaciones de estado, en esta guía estudiaremos otros factores que permiten el estudio más de tallados de su comportamiento como lo son: Coeficientes de expansión y de compresibilidad Ecuación calórica de estado Relación entre calores específicos Límites de utilización de la teoría de los gases calóricamente perfectos Gases reales Estados correspondientes Mezcla de gases Tablas de gas Coeficientes de expansión y de compresibilidad Un gas que se comporta como perfecto, el volumen específico es una función de la presión y de la temperatura a que se encuentra, en base a esto se pueden definir dos coeficientes: el coeficiente de expansión y el coeficiente de compresibilidad. En efecto, diferenciando la ecuación 𝑣= v(𝑇,𝑃), obtenemos: Nota: buscar definición de coeficiente de expansión y el coeficiente de compresibilidad La variación relativa elemental del volumen específico viene dada por 𝑑𝑣 𝑣 ; así pues, Por consiguiente, resulta: Coeficiente de expiación térmica Coeficiente de compresibilidad isotérmica Para un gas ideal se enfoca en el volumen 𝑃𝑉 = 𝑛𝑅𝑇
- 3. Ecuación calórica de estado La energía interna de cualquier gas puede expresarse por el funcional conocido como ecuación calórica de estado: Por tanto, resulta u = u (T ). Es decir, la energía interna de un gas térmicamente perfecto depende solo de su temperatura, conclusión acorde con el resultado de la teoría cinética de los gases. Por definición de calor específico, en este caso podemos escribir v du = c dT , e integrando se obtiene: Relaciones entre calores específicos. Nota: Investigar que es Cp y Cv En el contexto de la teoría cinética de los gases. En dicha teoría, el calor δQ requerido para elevar la temperatura de un gas una cantidad dT es almacenado en él como energía cinética de sus moléculas. Para un gas monoatómico, la teoría deduce, para la energía cinética en términos moleculares, la ecuación, Ahora bien, ; por tanto, si denotamos la capacidad molar de calor del gas a volumen constante, que representa el incremento de energía cinética interna por mol de gas y cambio por unidad de temperatura, resulta =
- 4. La ecuación anterior indica que, para un gas perfecto, el calor específico es independiente de la presión y de la temperatura del gas. Dicha ecuación da valores para el calor específico de los gases monoatómicos que difieren poco de los obtenidos experimentalmente. El valor del factor numérico de la ecuación anterior es distinto según sea el tamaño molecular del gas y, por consiguiente, sus grados de libertad, pues el teorema de equipartición de Maxwell enuncia que la energía cinética de una molécula se reparte igual entre todos sus grados de libertad. Los resultados que aporta la teoría son Un segundo calor específico de los gases térmicamente perfectos es el que resulta del proceso energético a presión constante. En efecto, de conformidad con la primera ley de la termodinámica, en un proceso reversible se cumple la ecuación siguiente: Por consiguiente, representa un nuevo calor específico a presión constante, que denotamos 𝑐𝑃, de modo que la ecuación anterior. Sea 𝛾 = 𝑐𝑃⁄𝑐𝑣 la relación de calores específicos para un gas perfecto. Entonces, a partir de la ecuación anterior, se obtiene:
- 5. Los valores de 𝛾 para varias clases de gases perfectos son, conforme a la teoría cinética, los siguientes: Gases monoatómicos: γ = 5 / 3 , exacto Gases diatómicos: γ = 7 / 5 = 1,40 , aproximado Gases poliatómicos: γ = 8 / 6 ≅ 1,33 , aproximado Límites de utilización de la teoría de los gases calóricamente perfectos Teniendo en cuenta lo expuesto hasta este momento la simplicidad de los cálculos bajo la hipótesis de un gas calóricamente perfecto (Un gas que tiene un valor de 𝑐𝑣 constante se denomina gas calóricamente perfecto) incita a aplicarlos siempre en una primera aproximación. Sin embargo, los efectos que resultan del calentamiento de un gas se manifiestan, en definitiva, como ya se ha expuesto, por una variación de los valores de los calores específicos, o sea, de γ. Esto puede ser altamente significativo en la dinámica de gases de toberas que descargan gases de combustión. Un claro ejemplo de esto se ve reflejada en la siguiente gráfica. Muestra la variación de γ para los gases de combustión de keroseno en el aire, tomando como parámetro la riqueza de la mezcla R=( flujomásico de keroseno)/( flujomásicodeaire) Se observa que, para T < 600 K, se puede admitir el valor γ =1,4. En el intervalo 600 < T < 1.600, el gas de combustión se comporta todavía como térmicamente perfecto, pero γ varía mucho con T, habida cuenta de la influencia de los fenómenos de vibración molecular. Para 1.600 < T, γ varía con T y con P en función de las disociaciones. En este intervalo de temperatura, el aire deja de comportarse como gas perfecto, por lo cual es necesario recurrir al diagrama de Mollier. Es lo que ocurre, por ejemplo, con los estatorreactores hipersónicos. Gases reales: El gas térmica y calóricamente perfecto es una idealización. Los gases reales tienen un comportamiento que se desvía en mayor o menor grado del de los gases ideales. Los denominados “efectos de gas real” se manifiestan prioritariamente en condiciones de altas temperaturas y bajas presiones.
- 6. Todo gas real puede ser licuado. La temperatura más alta a que es posible este cambio de fase recibe el nombre de temperatura crítica 𝑇𝑐; la presión y la densidad correspondientes se denominan presión crítica Pc y densidad crítica ρc. Estas variables críticas son características de cada gas, pues dependen de las fuerzas intermoleculares Nota: Un simple modelo de órdenes de magnitud explica que un gas puede licuarse a temperaturas superiores a la definida por el cociente entre la energía potencial de separación molecular y la constante de Boltzmann, o sea, T > (Δε / K). Por consiguiente, en el límite T = (Δε / K ) , la temperatura es crítica. La ecuación de estado de un gas real debe implicar al menos dos parámetros además de R ; por ejemplo, y T c P c. Teniendo esto en cuenta se presenta las fórmulas de estado de los gases reales. Ecuación de estado de Van der Waals, que se puede utilizar para estimar el valor aproximado al de un gas perfecto de gases reales a densidades moderadas. Dicha ecuación se escribe. El efecto de las fuerzas de Van der Waals se puede expresar, en una primera aproximación, en términos del denominado segundo coeficiente del virial (El segundo coeficiente virial B mide las interacciones entre pares de moléculas) de manera que PV = RT puede escribirse así: El término de corrección 𝑏(𝑇)𝑃⁄𝑅T difiere de gas a gas; sin embargo, para el limitado número de gases que tienen interés en dinámica de gases es posible introducir variables adimensionales, que transforman la ecuación anterior en una forma universal: En la ecuación anterior, 𝑃𝑐 𝑣𝑐⁄𝑅𝑇𝑐 es una constante 𝑘 cuyo valor es aproximadamente elmismo para todos los gases que interesan (𝑘 = 0,295). A su vez, 𝑏(𝑇)⁄𝑣𝑐 es aproximadamente una función universal de 𝑇𝑐⁄𝑇 para dichos gases. Por tanto, la ecuación se puede escribir así:
- 7. Donde ф(𝑇𝑐⁄𝑇) es la misma función para todos los gases que tienen interés en dinámica de gases. Algunos de sus valores son: La ecuación de Van der Waals puede expresarse en términos de los valores críticos de las variables de estado. Adoptando las cifras adimensionales En la siguiente tabla se muestra los valores críticos y las temperaturas características de varios gases. La ecuación de estado más general para los gases reales se escribe formalmente en términos del “factor de compresibilidad” Z. Su expresión es: Para los gases perfectos, Z = 1. Las desviaciones del valor de Z con respecto a la unidad se deben principalmente a dos causas: A bajas temperaturas y altas presiones, las fuerzas intermoleculares resultan importantes. Son las denominadas fuerzas de Van der Waals, que dan una explicación a la posibilidad de licuar un gas. A altas temperaturas y bajas presiones, ocurren procesos de disociación y de ionización. Nota: al factor de compresibilidad Z, cabe avanzar que se representa habitualmente como una función de la presión
- 8. reducida P/Pc para diferentes valores de la temperatura reducida T/Tc. Para valores de la temperatura reducida Tr>2, o bien Pr<0,05 aproximadamente, la curva Z vs (P/Pc) es prácticamente horizontal, con un valor de 1 Según el teorema de los estados correspondientes, los factores de compresibilidad Z de dos gases son iguales si los parámetros de estado reducidos de ambos Pr = P / Pc , Tr = T / Tc , son iguales. En el caso de las mezclas de gases, los parámetros de estado reducidos se han de sustituir por los parámetros pseudorreducidos y Ppr y Tpr , definidos en términos de la presión y de la temperatura pseudocríticas y Ppc Tpc, ambas dependientes de la composición del gas, definidas como: Si la composición del gas es conocida, se pueden determinar los valores de 𝑃𝑝c 𝑦 𝑇𝑝c aplicando el principio de la aditividad. La aditividad significa que la masa molar, la presión y la temperatura pseudocríticas de una mezcla pueden expresarse como el resultado de la suma de los parámetros respectivos de los componentes, combinados con sus fracciones molares o en volumen. Definidas la temperatura crítica, la presión crítica y el volumen molar crítico (o bien la densidad crítica), la ecuación de estado se puede expresar en términos de los parámetros reducidos: Entonces, el factor de la compresibilidad reducido 𝑍𝑟 es: En los gases más comunes, su valor se sitúa en el intervalo 0,25 ≤ Z≤ 0,30. La figura siuientes muestra el valor de 𝑍 en función de la presión y de la temperatura reducidas.
- 9. En el caso particular de los gases naturales, se ha desarrollado una única correlación para la predicción del factor de compresibilidad, que cubre el campo global que interesa de dichos gases. La ecuación de estado elegida para ese estudio fue una ecuación virial. La forma de la serie virial utilizada es la siguiente: Donde n es el número de componentes en el gas natural, y Xj y Xk representan las fracciones molares de los componentes i, j, k. La ecuación anterior es el resultado de un procedimiento de aproximación razonable que conduce a una ecuación precisa del gas real para la predicción de los factores de compresibilidad de los gases naturales. Ahora bien, la predicción de ciertas propiedades mediante dicha ecuación, particularmente en condiciones extremas de presión y de temperatura, no sería suficientemente precisa para su aplicación práctica. De hecho, no existe una ecuación universal de estado que sea aplicable generalmente a todos los problemas. Cada ecuación de estado (Benedict-Webb-Rubin, Redlich-Kwong-Soave, British Gas y Peng- Robinson son las más utilizadas, en general) tiene sus propias ventajas y limitaciones particulares. Mezcla de gases. En general, los gases con que se opera en tecnología están constituidos por varias especies simples, que son sus componentes. Se trata realmente de una mezcla de gases cuyas propiedades dependen de las de los gases individuales componentes y de su proporción en la mezcla. Si la composición de un gas es conocida, se pueden determinar los valores de P, Ppr, Tpr, etc., aplicando las leyes de Dalton y de Amagat, o bien aplicando el principio de aditividad. Investigar: Leyes de Dalton Leyes de Amagat,
- 10. Principio de aditividad. La ley de Dalton estipula que la presión de una mezcla de gases, denotada por P, es igual a la suma de las presiones parciales 𝑃𝑖 de cada una de las especies. La presión parcial Pi se define como la presión que cada especie ejercería si ocupase el volumen total de la mezcla por sí misma a la temperatura de la mezcla T. Para una mezcla de n componentes, se expresa así: La ley de Amagat indica que el volumen V de una mezcla de n gases componentes es la suma de los volúmenes Vi que cada una de las especies ocuparía por sí misma a la presión P y a la temperatura T de la mezcla. Su expresión es:
- 11. Las funciones del estado termodinámico de la mezcla de gases se expresan, en términos de masa, de la forma siguiente: Se supone que cada especie de una mezcla de gases se comporta como un gas perfecto. En las tablas SIGUIENTES, se dan los valores de temperatura, presión y densidad críticas de diversos gases y, se dan los valores de los parámetros físicos de algunos gases hidrocarburos en condiciones normales.
- 12. Teniendo en cuenta lo anteriormente mencionado se debe puntualizar que la energía de una mezcla de gases viene dada por la suma de las energías de cada especie presente, o sea: expresión en que es la energía por mol del gas, x i es la fracción molar de cada especie presente y es su energía por mol. Para cada estado, las fracciones molares se pueden determinar a partir de las constantes de equilibrio y la energía de cada una de las especies, a partir de las funciones de partición. La figura siguiente muestra la energía interna del aire como una función de la temperatura a varias presiones, expresada en términos del parámetro adimensional La figura siguiente muestra los valores de Z en función de la temperatura para varios valores de presión. A partir del valor de Z , la energía por mol de un gas no disociado viene dada por:
- 13. De este modo el calor específico por mol de un gas no disociado es: En la ecuación anterior, es el calor específico del gas por mol a una temperatura y a una presión dadas, la es energía por mol de cada una de las especies presentes y es su fracción molar. El segundo término de la ecuación tiene en cuenta el cambio de composición del gas debido a los cambios de temperatura. A veces, como cuando se trata de un flujo congelado, es más conveniente operar con el C v ′ parcial, o calor específico congelado, definido por: En equilibrio, el calor específico del aire a presión constante por mol de gas no disociado viene dado por:
- 14. A partir de las ecuaciones Se obtiene la relación de calores específicos γ. La figura siguiente muestra una gráfica de γ en función de la temperatura a varias presiones. Se dan los valores de los parámetros pseudocríticos Pc y Tc de los gases naturales, en función de la masa molar.
- 15. La figura 1.10 ilustra los valores de los parámetros reducidos del gas natural p pc y Tpc en función de la masa molar y la figura 1.11 muestra la influencia de T r y P r en los valores de los calores específicos de los gases reales. La figura 1.12 muestra la variación del valor de (cp − cv ) de los gases reales en función de T r y P r.
- 16. Para calcular las relaciones entre 𝑃, 𝑣 y 𝑇, la ecuación 𝑃V = 𝑅T da resultados considerados exactos para todos los gases cuando la presión es baja, y muy aproximados cuando la presión es una fracción grande de la presión crítica, siempre que la temperatura sea mucho mayor que la crítica. Para la resolución de muchos problemas de ingeniería que implican gases reales, dicha ecuación también es válida a efectos prácticos. Ahora bien, cuando no se cumplen las condiciones especificadas, los resultados que se obtienen utilizando esta ecuación difieren considerablemente de los valores reales. Las desviaciones son inadmisibles, a los efectos de aplicar las propiedades termodinámicas de dichos gases en ingeniería, particularmente de sus calores específicos 𝑐𝑃, 𝑐𝑣, que varían significativamente con la temperatura. En tales casos, se requiere una ecuación de estado distinta, como la de Van der Waals o, incluso, una ecuación polinómica. Por ejemplo, para correlacionar los datos empíricos de 𝑐𝑐𝑃𝑃 para diferentes gases en función de la temperatura T a que se encuentra el gas, se han propuesto varias ecuaciones polinómicas y exponenciales. Los valores de 𝑢 y de ℎ de un gas real pueden tabularse como funciones de la temperatura si, para su cálculo, se emplean los valores instantáneos de cv y de cp. Para establecer la correlación de los valores empíricos de p c de diferentes gases en función de su temperatura 𝑇, se han propuesto varias fórmulas; las más habituales son polinomios y ecuaciones exponenciales. Aquí se adoptan polinomios de la forma:
- 17. Para realizar el análisis termodinámico de procesos de dinámica de gases a temperatura elevada, las ecuaciones para el cálculo del valor del calor específico, como por ejemplo la ecuación anterior, son, en general, demasiado engorrosas. Por ello, en la práctica, es habitual utilizar los valores que se encuentran en tablas, que incluyen también otras propiedades termodinámicas pertinentes, como u ⋅ h, Pr , Tr ,γ , etc. Véase, por ejemplo, la tabla siguiente, que es una pequeña parte de la tabla general.