Luis fernado
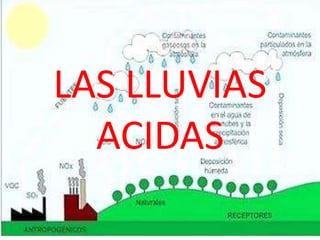
- 2. LAS LLUVIAS ACIDAS La lluvia ácida es aquella lluvia, que debido a la contaminación cuenta, en su composición, con ciertos montos de ácido nítrico o ácido sulfúrico. La lluvia ácida es provocada por los humos y los gases emitidos por los automóviles y las industrias.
- 3. El término lluvia ácida pertenece a Angus Smith, un químico británico del siglo XIX que estudió el aire de Manchester (Inglaterra). Pero no fue hasta 1950 cuando se reconoció la existencia de esta lluvia ácida y su poder de contaminación de grandes áreas. La preocupación aumentó cuando pescadores observaron grandes menguas en las poblaciones de peces en muchos lagos de Suecia, Ontario (Canadá) y Adirondack (Nueva York). En Noruega y Suecia los peces han desaparecido de por lo menos 6500 lagos, de otros 1200 lagos en Ontario y más de 200 en los Adirondack. Algunos sólo albergan algas y bacterias resistentes.
- 4. El termino "lluvia ácida" abarca la sedimentación tanto húmeda como seca de contaminantes ácidos que pueden producir el deterioro de la superficie de los materiales. Estos contaminantes que escapan a la atmósfera al quemarse carbón y otros componentes fósiles reaccionan con el agua y los oxidantes de la atmósfera y se transforman químicamente en ácido sulfúrico y nítrico. Los compuestos ácidos se precipitan entonces a la tierra en forma de lluvia, nieve o niebla, o pueden unirse a partículas secas y caer en forma de sedimentación seca.
- 5. La acidez se mide en una escala de 1 a 14 conocida como escala de pH. El pH mide la concentración de ion hidrógeno (H+, átomos sin su electrón) de forma que si el pH es menor a 7 se dice que estamos ante un ácido, y si el pH es mayor a 7 se dice que estamos ante una base o una solución alcalina (con más iones hidróxido, OH-). Un pH de 7 expresa una solución neutra, es decir, ni ácida ni básica (con una concentración de iones de hidrógeno igual a la de iones hidróxido: 10-7 g/L). Cuanto más alejado del número 7 sea el pH de una solución más ácida o básica será variando la acidez en 10 veces cada unidad de la escala pH. Es decir, un pH de 4 es diez veces más ácido que un pH de 5, y cien veces más ácido que un pH de 6.
- 6. CONSECUENCIAS Las consecuencias de la lluvia ácida son múltiples. Entre los efectos más comunes se encuentra el efecto negativo que produce sobre el crecimiento de las plantas, las que sufren un importante debilitamiento y la caída de sus hojas. Además éstos ácidos destruyen ciertos elementos esenciales de los suelos y depositan metales nocivos como el aluminio, afectando e interfiriendo en la respiración y fotosístensis de las plantas
- 7. EFECTOS Sus efectos en la ciudad también se sienten, ya que dichos ácidos reacciones con los minerales metálicos, formando sales, como el carbonato de calcio, más conocido como yeso. Por lo tanto, produce la erosión tanto de edificios como monumentos, entre otros. Lo anterior ocurre cuando la lluvia arrastra el yeso y el ácido que posee erosiona las piedras.
- 8. La cantidad de ácido nítrico y sulfúrico que caen en nuestros suelos es acumulativo y, progresivamente, implica que las aguas subterráneas también comienzan a contaminarse, trayendo consecuencias graves en la salud humana. Entre estos efectos se encuentra la presencia de metales en la cadena alimenticia, haciendo que los huesos, hígado y riñones comiencen a acumular plomo.
- 9. Los contaminantes atmosféricos primarios que dan origen a la lluvia ácida pueden recorrer grandes distancias, siendo trasladados por los vientos cientos o miles de kilómetros antes de precipitar en forma de rocío, lluvia, llovizna, granizo, nieve, niebla o neblina. Cuando la precipitación se produce, puede provocar importantes deterioros en el ambiente.
- 10. La lluvia normalmente presenta un pH de aproximadamente 5.65 (ligeramente ácido), debido a la presencia del CO2 atmosférico, que forma ácido carbónico, H2CO3. Se considera lluvia ácida si presenta un pH de menos de 5 y puede alcanzar el pH del vinagre (pH 3). Estos valores de pH se alcanzan por la presencia de ácidos como el ácido sulfúrico, H2SO4, y el ácido nítrico, HNO3. Estos ácidos se forman a partir del dióxido de azufre, SO2, y el monóxido de nitrógeno que se convierten en ácidos.
- 11. La lluvia normalmente presenta un pH de aproximadamente 5.65 (ligeramente ácido), debido a la presencia del CO2 atmosférico, que forma ácido carbónico, H2CO3. Se considera lluvia ácida si presenta un pH de menos de 5 y puede alcanzar el pH del vinagre (pH 3). Estos valores de pH se alcanzan por la presencia de ácidos como el ácido sulfúrico, H2SO4, y el ácido nítrico, HNO3. Estos ácidos se forman a partir del dióxido de azufre, SO2, y el monóxido de nitrógeno que se convierten en ácidos
- 12. Una gran parte del SO2 (dióxido de azufre) emitido a la atmósfera procede de la emisión natural que se produce por las erupciones volcánicas, que son fenómenos irregulares. Sin embargo, una de las fuentes de SO2 es la industria metalúrgica. El SO2 puede proceder también de otras fuentes, por ejemplo como el sulfuro de dimetilo, (CH3)2S, y otros derivados, o como sulfuro de hidrógeno, H2S. Estos compuestos se oxidan con el oxígeno atmosférico dando SO2. Finalmente el SO2 se oxida a SO3 (interviniendo en la reacción radicales hidroxilo y oxígeno) y este SO3 puede quedar disuelto en las gotas de lluvia, es el de las emisiones de SO2 en procesos de obtención de energía: el carbón, el petróleo y otros combustibles fósiles contienen azufre en unas cantidades variables (generalmente más del 1%), y, debido a la combustión, el azufre se oxida a dióxido de azufre.
- 13. Los nitratos y sulfatos, sumados a los cationes lixiviados de los suelos, contribuyen a la eutrofización de ríos y lagos, embalses y regiones costeras, lo que deteriora sus condiciones ambientales naturales y afecta negativamente a su aprovechamiento. Un estudio realizado en 2005 por VincentGauci[1] de Open University, sugiere que cantidades relativamente pequeñas de sulfato presentes en la lluvia ácida tienen una fuerte influencia en la reducción de gas metano producido por metanógenos en áreas pantanosas, lo cual podría tener un impacto, aunque sea leve, en el efecto invernadero.[2]
- 14. LLUVIA ÁCIDA: VENENO CAÍDO DEL CIELO La quema de combustibles fósiles y la industrialización en general está provocando cambios en la atmósfera. Uno de los efectos más conocidos es el calentamiento global o efecto invernadero, cuyas devastadoras consecuencias han sido expuestas en foros internacionales y el acuerdo es tan abrumador que dio lugar al Protocolo de Kioto...
- 15. La lluvia ácida por su carácter corrosivo, corroe las construcciones y las infraestructuras. Puede disolver, por ejemplo, el carbonato de calcio, CaCO3, y afectar de esta forma a los monumentos y edificaciones construidas con mármol o caliza. Un efecto indirecto muy importante es que los protones, H+, procedentes de la lluvia ácida arrastran ciertos iones del suelo. Por ejemplo, cationes de hierro, calcio, aluminio, plomo o zinc. Como consecuencia, se produce un empobrecimiento en ciertos nutrientes esenciales y el denominado estrés en las plantas, que las hace más vulnerables a las plagas.
- 16. La quema de combustibles fósiles y la industrialización en general está provocando cambios en la atmósfera. Uno de los efectos más conocidos es el calentamiento global o efecto invernadero, cuyas devastadoras consecuencias han sido expuestas en foros internacionales y el acuerdo es tan abrumador que dio lugar al Protocolo de Kioto, aunque el país más contaminante, EE.UU., se niega a ratificarlo por miedo a una recesión en su economía, o por miedo a un declive de la industria petrolera, en la que tienen intereses muchos miembros del gobierno estadounidense, incluyendo al propio presidente George W. Bush. Sin embargo, otra consecuencia de esa contaminación es la lluvia ácida, cuyos efectos son muy conocidos, aunque los políticos le presten poca atención.
- 17. En los ecosistemas acuáticos: La acidificación de lagos y ríos conlleva un trastorno en la cadena alimenticia ocasionado por la muerte de muchos peces, la intoxicación por comer este pescado y la reducción de zooplancton, algas y plantas acuáticas. El aluminio es un metal que se disuelve con la lluvia ácida y contamina el agua. Por debajo de un pH de 5 ya se presenta contaminación por aluminio. Entre otros problemas, esto genera daños en las branquias y que los peces dejen de reproducirse. Los anfibios, moluscos y crustáceos son parte importante en la cadena alimenticia de los ecosistemas acuáticos y también se ven seriamente afectados. Por ejemplo, el agua ácida disuelve con facilidad el carbonato de calcio interfiriendo en que los moluscos lo incorporen a su concha. La contaminación por mercurio también es agravada por la lluvia ácida y en los Grandes Lagos de Norteamérica la concentración es tan elevada que está prohibido consumir ese pescado.
- 18. SOLUCIONES Entre las medidas que se pueden tomar para reducir la emisión de los contaminantes precursores de éste problema tenemos las siguientes: Reducir el nivel máximo de azufre en diferentes combustibles. Trabajar en conjunto con las fuentes fijas de la industria para establecer disminuciones en la emisión de SOx y NOx, usando tecnologías para control de emisión de estos óxidos. Impulsar el uso de gas natural en diversas industrias. Introducir el convertidor catalítico de tres vías. La conversión a gas en vehículos de empresas mercantiles y del gobierno.
- 19. CONCLUCION No agregar muchas sustancias químicas en los cultivos. Adición de un compuesto alcalino en lagos y ríos para neutralizar el pH. Control de las condiciones de combustión (temperatura, oxigeno, etc.).
- 20. Si las lluvias ácidas continúan y no hacemos algo urgente al respecto, entonces a lo largo del tiempo seremos testigos de la desaparición de nuestros bosques, con todo lo que esto implica. OBSERVACIONES