Enlaces Químicos Iónicos y Covalentes
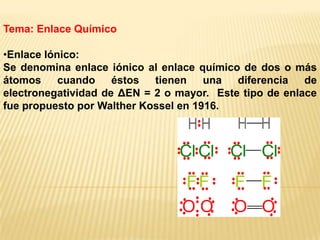
- 1. Tema: Enlace Químico •Enlace Iónico: Se denomina enlace iónico al enlace químico de dos o más átomos cuando éstos tienen una diferencia de electronegatividad de ΔEN = 2 o mayor. Este tipo de enlace fue propuesto por Walther Kossel en 1916.
- 2. En una unión de dos átomos por enlace iónico, un electrón abandona el átomo más electropositivo y pasa a formar parte de la nube electrónica del más electronegativo. El cloruro de sodio (la sal común) es un ejemplo de enlace iónico: en él se combinan sodio y cloro, perdiendo el primero un electrón que es capturado por el segundo: NaCl → Na+Cl-
- 3. Algunas características de este tipo de enlace son: •Son sólidos de estructura cristalina en el sistema cúbico. •Altos puntos de fusión (entre 300 °C y 1000 °C y ebullición. •Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII. •Son solubles en agua y otras disoluciones acuosas. •Una vez en solución acuosa son excelentes conductores de electricidad.
- 4. •Enlace Covalente. Un enlace covalente entre dos átomos o grupos de átomos se produce cuando estos, para alcanzar el octeto estable, comparten electrones del último nivel. La diferencia de electronegatividades entre los átomos no es suficiente. Tipos de sustancias covalentes Sustancias covalentes moleculares: los enlaces covalentes forman moléculas que tienen las siguientes propiedades: •Temperaturas de fusión y ebullición bajas. •En condiciones normales de presión y temperatura (25 °C aprox.) pueden ser sólidos, líquidos o gaseosos •Son blandos en estado sólido. •Son aislantes de corriente eléctrica y calor.
- 5. Redes o sustancias covalentes reticulares: Además las sustancias covalentes forman redes, semejantes a los compuestos iónicos, que tienen estas propiedades: •Elevadas temperaturas de fusión y ebullición. •Son sólidos. •Son sustancias muy duras (excepto el grafito). •Son aislantes (excepto el grafito). •Son insolubles.