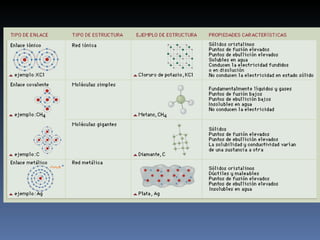
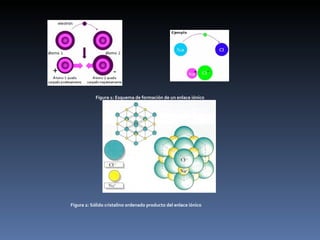
Este documento describe los enlaces iónicos. Explica que ocurren cuando los átomos de metales ceden electrones a átomos de no metales, formando iones con cargas opuestas que se atraen electrostáticamente. Los materiales iónicos conducen electricidad como líquidos o en disolución, pero no en estado sólido donde los iones no pueden moverse libremente. Como ejemplo, describe la reacción del sodio con el cloro, donde el sodio pierde un electrón al cloro, formando iones Na+ y Cl-.