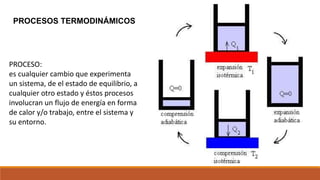
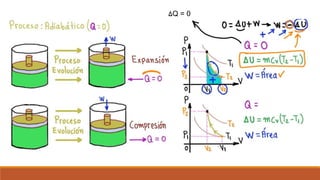
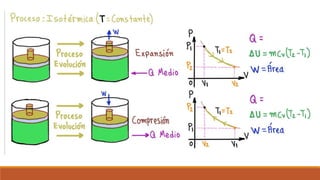
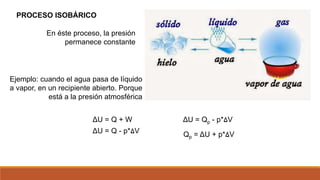
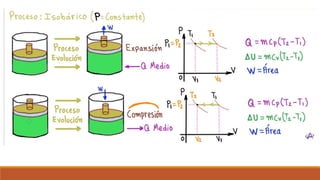
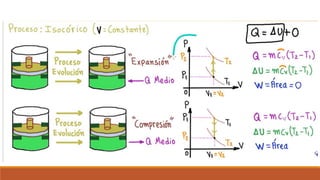
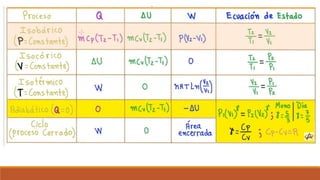
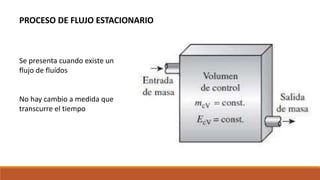
El documento resume los principales procesos termodinámicos: procesos isotérmicos, adiabáticos, isocóricos e isobáricos. Estos procesos involucran cambios en la energía interna, calor y trabajo de un sistema. También define procesos cuasi-estáticos, de flujo estacionario y presenta una tabla resumen de las características de cada proceso termodinámico.