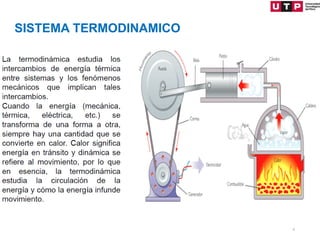
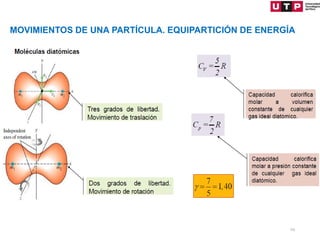
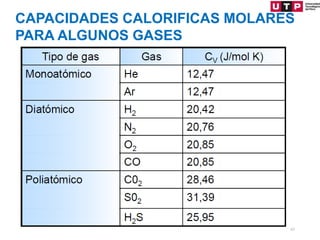
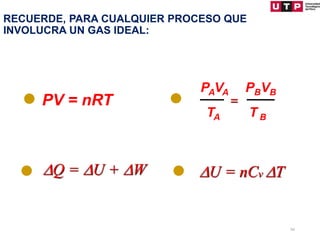
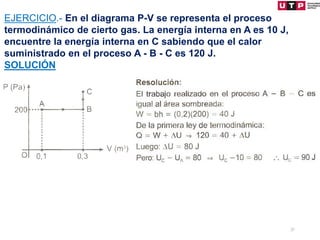
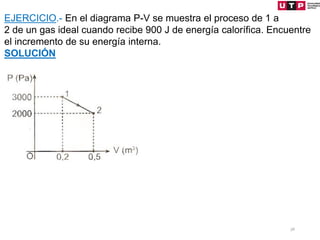
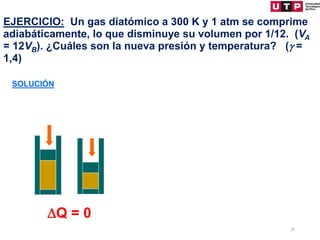
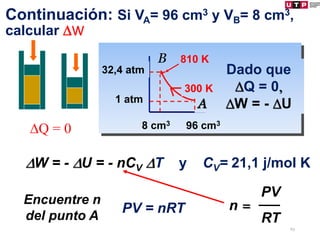
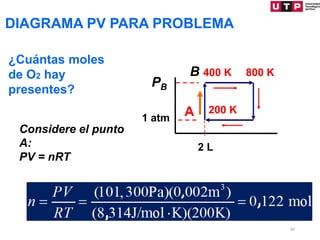
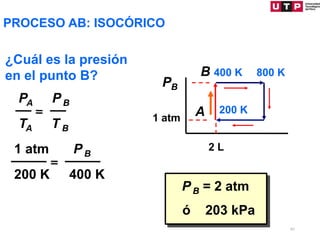
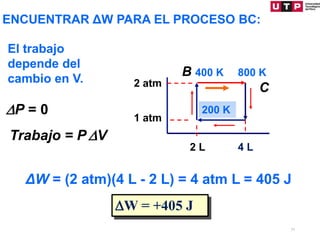
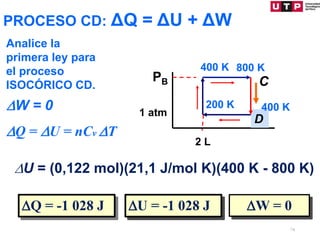
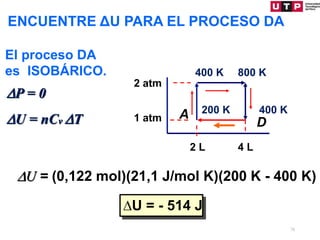
1) El documento describe los conceptos fundamentales de la primera ley de la termodinámica.
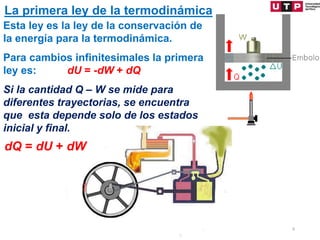
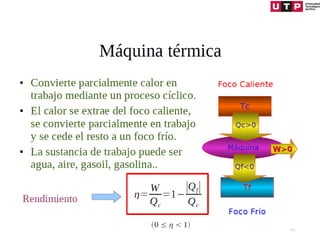
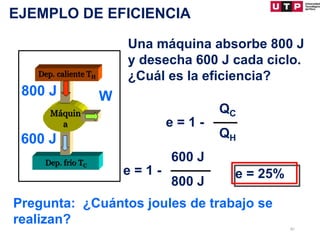
2) La primera ley establece que el cambio en la energía interna de un sistema es igual al calor agregado menos el trabajo realizado.
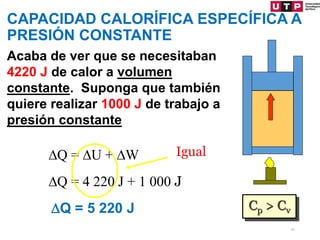
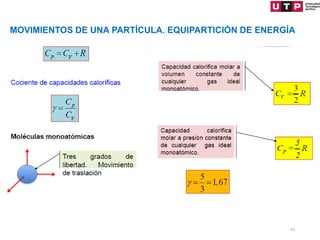
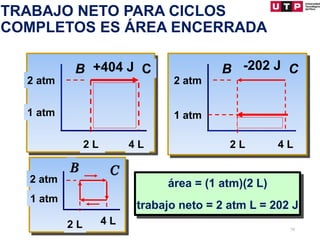
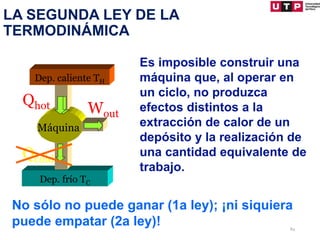
3) Se explican algunas consecuencias de la primera ley como que para un sistema aislado o un proceso cíclico, el cambio en la energía interna es cero.