2. Mezcla rapida y coagulacion.pptx
- 3. Considere dos experimentos: Partículas de tamaño coloidal = macromoléculas Dos fases agitar Solución verdadera Dos fases agitar Coloide Dos fases Presencia de límites
- 4. Coloides Partículas, macromoléculas Tipo partícula Tamaño partícula Solución verdadera Iones, moléculas pequeñas 0.1-1nm 1-100nm Suspensiones Partículas grandes 100nmy mayores -Arcilla -sedimento -materia orgánica einorgánica -plancton y otros microorganismosmicroscópicos. -Partículas de materia orgánica e hidróxidos de metal (hierro por ejemplo). TURBIEDAD C OL OR
- 5. Laspartículas en suspensión de una fuente de aguasuperficial provienende: *La erosión de suelos. *La disolución de sustanciasminerales y de *La descomposición de sustancias orgánicas. La turbiedad en el agua es causada por materia suspendida y coloidal tal como arcilla, sedimento, materia orgánica e inorgánica dividida finamente, plancton y otros microorganismos microscópicos; en tanto que el color está formado por partículas de materias orgánicas e hidróxidos de metal (hierro por ejemplo). https://www.youtube. com/watch?v=WoAU_6abKL4 Coloides
- 6. Enla siguientefigurase presentaun ejemploendonde se muestranlos trescomponentesde uncoloide: Agregados de H2O Fase dispersa Aceite Fase continua (medio) Agente estabilizante (emulsificador) Coloide
- 7. Tabla:Tiposde coloidesyejemplos Fase dispersa (similaral soluto) Fase continua (similar al disolvente) Clasificación Ejemplos sólido sólido solsólido Rubí,porcelana líquido sólido emulsionsólidao gel Mantequilla,gelde cabello gas sólido espumasólida Esponja,piedrapómez, malvavisco sólido líquido sol Agua turbia,agua coloreada líquido líquido emulsión Aceiteenagua gas líquido espuma Cremadeafeitar,crema batida. sólido gas aerosolsólido Humo,virusquese trasporta por elaire líquido gas aerosollíquido Neblina, humedad,nubes
- 8. 1. Propiedades eléctricas 2. Propiedades cinéticas Movimiento Browniano 3. Propiedades ópticas EfectoTyndall-Faraday Coloración 4. Propiedades de superficie (adsorción) Propiedadesdeloscoloides
- 9. 1. Propiedadeseléctricas T odo sólido sumergido en un líquido tiende a cargarse eléctricamente ensusuperficie 1Por adsorción de iones delmedio. 2Por ionización de grupos funcionales en su superficie (en este caso,el pHdel medio juega un papelimportante). Poseen una carga eléctrica negativa sobre su superficie, que atrae los iones positivos del agua (capa comprimida). Los iones positivos del agua atraen iones negativos acompañados de una débil cantidad de iones positivos (capadifusa). Segenera una doblecapaeléctrica Potencial Zeta: potencial electrostático entre la superficie de la partícula y la solución.
- 10. Movimiento Browniano El movimiento browniano es el movimiento aleatorio que se observa en algunas partículas microscópicas que sehallan en un medio fluido *Se caracteriza porque las partículas cambian de velocidad y dirección erráticamente. *Ocurre según las partículas colisionan con las moléculas del medio dispersor. *Es el principal factor al cual se le atribuye que las partículas coloidales no sedimenten. 2. Propiedadescinéticas Verlaanimación: http://youtu.be/6VdMp46ZIL8
- 11. Difusión Movimiento incesante de las partículas coloidales el cual hace que éstas se difundan y se distribuyan uniformemente en el solvente. La velocidad de difusión es mucho menor que la velocidad media de la particula en el movimiento browniano. 2. Propiedadescinéticas PresiónOsmótica La presión osmótica puede definirse como la presión que se debe aplicar a una solución para detener el flujo neto de disolvente a través de una membrana semipermeable.
- 12. EfectoTyndall-Faraday Ladispersión de la luz al pasar através de una suspensión coloidal esdenomina Efecto Tyndall proporcional ala turbiedad. Ver: http://youtu.be/NxldP1wK-f4 Coloración Estopuede deberse: l. Ala diseminación de la luz. 2.Ala absorción selectiva por el coloide de una cierta longitud deonda. Lacoloración puede usarsetambién para medir la concentración de loscoloides. 3. Propiedadesópticas
- 13. Aesta adherencia en la superficie de una partícula se le llama adsorción, la cual para que seproduzca requiere que: *El adsorbido tenga baja solubilidad en agua *Exista una afinidad entre el soluto (coagulante) y el coloide. 4.Propiedadesdesuperficie(adsorción)
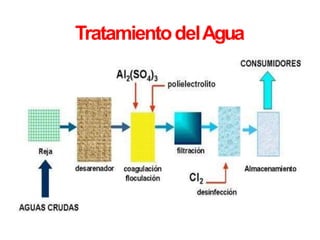
- 15. COAGULACIÓNYFLOCULACIÓN COAGULACIÓN desestabilizar las partículas en suspensión es decir facilitar su aglomeración. inyección y dispersión rápida de productos químicos. FLOCULACIÓNfavorece con la ayuda de la mezcla lenta el contacto entre las partículas desestabilizadas. Estas partículas se aglutinan para formar un floc que pueda ser fácilmente eliminado por los procedimientos de decantación yfiltración.
- 16. Métodosusadosparacoagularlaspartículas decoloideydestruirladispersióncoloidal: • Calentamiento – ocasiona que las partículas de coloide se muevan más rápido y choquen con más frecuencia y con la suficiente fuerza para incorporarseenpartículasmásgrandesquesesedimentan. • Adición de solución de electrolito (para partículas con carga) – introduce cargas opuestas de iones que neutralizan la carga en la superficie de las partículasqueeventualmentecoagulanysedimentan. • Precipitador de Cottrell (para partículas sin carga)– las partículas pasanpor unazonadedescargaeléctricaendondeionizanparaluegoseratraídaspor placascargadasyasílaspartículassonremovidas.
- 17. Estabilidadde lossistemas dispersos Gradodedispersióndela fase interna Siel grado de dispersión de la faseinterna eselevado y homogéneo, aumenta la estabilidad del sistema. Temperatura Elaumento de la temperatura reduce laestabilidad de lossistemas dispersos al disminuir la viscosidad y aumentar la movilidad de las partículas o gotitas dispersas. Viscosidad Elagregado de sustancias aun sistema disperso con propiedades reológicas favorece la estabilidad.Al aumentar la viscosidad del medio dificulta la movilidad de las partículas impidiendo que se aproximen.
- 18. Disminución del espesor de la capa difusa y por tanto de su efecto protector del coloide. Adsorción de iones en la capa fija, lo que produce una disminución del potencial zeta. Ambos efectos explican la acción precipitante de los electrolitos sobre los coloides. El efecto coagulante de estos iones de signo opuestoes mayor cuanto mayor essuvalencia. Efectosde la adiciónde electrolitos
- 19. Coagulantesutilizados Reaccionan con la alcalinidad del agua para formar un precipitado voluminoso, muy absorbente, constituido generalmente por el hidróxido metálico del coagulante que seestá utilizando. Losprincipales coagulantes utilizados para desestabilizar las partículas y producir el floc son: a) Sulfato deAluminio. b) Aluminato deSodio. c) Cloruro deAluminio. d) Cloruro Férrico. e) Sulfato Férrico. f) Sulfato Ferroso. g)Polielectrolitos (Como ayudantes de floculación).
- 20. Tiposde coagulación a) Coagulación Por Adsorción.- El agua presenta una alta concentración de partículas en estado coloidal; cuando el coagulante es adicionado al agua turbia, los productos solubles de los coagulantes son absorbidas por los coloides y forman los flóculos en forma casiinstantánea.
- 21. Tiposde coagulación a) Coagulación por Barrido.- El agua es clara (presenta baja turbiedad) y la cantidad de partículas coloides espequeña;en este caso las partículas son entrampadas al producirse una sobresaturación de precipitado de sulfato de aluminio o cloruro férrico.
- 23. Factoresqueinfluyenenla coagulación Es necesario tener en cuenta los siguientes factores con la finalidad de optimizar el proceso decoagulación 1. pH. 2. Turbiedad. 3. Salesdisueltas. 4. Temperatura del agua. 5. Tipo y dosis de coagulante utilizado. 6. Condiciones de Mezcla. 7. Sistemasde aplicación de los coagulantes. Lainterrelación entre cadauno de ellos permiten predecir cuáles son las cantidades de los coagulantes aadicionar al agua.
- 24. Factoresqueinfluyenenla coagulación 1. Influencia delpH El rango de pH es función del tipo de coagulante a ser utilizado y de la naturaleza del agua a tratar. Para sales de aluminio el rango de pH para la coagulación es de 6.5 a 8.0 y para las sales de hierro, el rango de pH óptimo es de 5.5 a 8.5 unidades.
- 25. Factoresqueinfluyenenla coagulación 2. Influencia de la turbiedad -Para cada turbiedad existe una cantidad de coagulante, con el que se obtiene la turbiedad residual mas baja, que corresponde a la dosis óptima. -Cuando la turbiedad es baja la coagulación se realiza muy difícilmente, y la cantidad del coagulante es igual o mayor que si la turbiedad fuesealta. -Cuando la turbiedad es muy alta, conviene realizar una presedimentación natural o forzada, en este caso con el empleo de un polímero aniónico. - Essiempre másfácil coagular las aguasde baja turbiedad y aquellas contaminadas por desagües domésticos industriales, por que requieren mayor cantidad de coagulante que los nocontaminados.
- 26. Factoresqueinfluyenenla coagulación 3. Influenciade lassales disueltas Las sales contenidas dentro del agua ejercen las influencias siguientes sobre la coagulación yfloculación: -Modificación del rango de pHóptimo. -Modificación del tiempo requerido para lafloculación. -Modificación de la cantidad de coagulantesrequeridos. -Modificación de la cantidad residual del coagulante dentro del efluente.
- 27. Factoresqueinfluyenenla coagulación 4. Influenciade la temperatura del agua La variación de 1°C en la temperatura del agua conduce a la variación de la densidad , lo cual afecta la energía cinética de las partículas en suspensión, por lo que la coagulación se hace mas lenta; temperaturas muy elevadasdesfavorecen igualmente ala coagulación. Una disminución de la temperatura del agua en una unidad de decantación conlleva a un aumento de su viscosidad; esto explica las dificultades de la sedimentación de un floc.
- 28. Factoresqueinfluyenenla coagulación 5. Influenciadel tipo y dosis del coagulante utilizado • Poca cantidad del coagulante, no neutraliza totalmente la carga de la partícula, la formación de los microflóculos es muy escaso,por lo tanto la turbiedad residual eselevada. • Alta cantidad de coagulante produce la inversión de la carga de la partícula, conduce a la formación de gran cantidad de microflóculos con tamaños muy pequeños cuyas velocidades de sedimentación muy bajas, por lo tanto la turbiedad residual esigualmenteelevada. • La selección del coagulante y la cantidad óptima de aplicación; se determina mediante los ensayos de pruebas de jarra.
- 29. Factoresqueinfluyenenla coagulación • 6. Condicionesdemezcla • Lainyección de productos químicos serealiza dentro de la zonade fuerte turbulencia. • Lasunidades paraproducir la mezclapueden ser: • MezcladoresMecánicos: • - Retromezcladores(agitadores) • MezcladoresHidráulicos: - R esalto Hidráulico: Canaleta P arshall y V ertedero Rectangular - Enlínea: Difusores (tuberías y canales),Inyectores,etc..
- 30. Factoresqueinfluyenenla coagulación 7. Sistemasdeaplicaciónde coagulantes El sistema de dosificación debe proporcionar un caudal constante y fácilmente regulable. Esta condición se obtiene por medio de los equipos de dosificación tanto para los coagulantes al estado sólido y estado líquido, que deben encontrarse calibrados y comprobados en la práctica por medio de las pruebas de aforamiento.
- 31. Factoresqueinfluyenenla coagulación 7. Sistemas de aplicación de coagulantes El sistema de dosificación debe proporcionar un caudal constante y fácilmente regulable. Los equipos de dosificación tanto para los coagulantes al estado sólido y estado líquido, deben encontrarse calibrados y comprobados en la práctica por medio de las pruebas de aforamiento.
- 32. Dosisdecoagulante • Cantidad de compuesto químico requerido en un proceso de coagulación, el cual seestandarizapor medio de la prueba dejarras. Vdosis= ρXQ PXC Donde: ρ=densidad del coagulante (mg/L) Q=caudal atratar (L/s) P=pureza delcoagulante C=concentración del coagulante ppm(mg/L)
- 33. Dosisde coagulante Zona1 .- Ladosis no essuficiente para desestabilizar las partículas y por lo tanto no seproducecoagulación. Zona2.- Al incrementar la dosis de coagulantes, seproduce una rápida aglutinación de los coloides. Zona3 .- Loscoloides se reestabilizan. Zona 4 .- Se produce una una supersaturación y una rápida precipitación de los coagulantes que hace un efecto de barrido, arrastrando en su descensolas partículas que conforman la turbiedad.
- 34. Ejemplo1. Dosis Se requiere construir un tanque de solución coagulante, para una planta cuyo caudal a tratar esde 50 L/s, pureza de 90%, concentración de 50 ppm y densidad de 50 mg/L. Cualesel volumen del tanque , si serequiere tratar durante un dia completo? Tenerencuenta un factor de seguridad del10%.
- 35. FLOCULACIÓN Partícula s primarias Flóculo(agregado) • Asociación de dos o máspartículas • LosFlóculos semovilizan como solo una unidad • No hay cambio en el áreasuperficial • ElFlóculo semantiene unido por: Interacción hidrofóbica, Vander Waals,electrostática-iónica, puentes deH.
- 36. Turbidez: cantidad y densidad del lodo. Color: cantidad de coagulante, floculante. Alcalinidad y pH: coagulación, floculación. Temperatura: verano, invierno. Variablesqueinfluyenenla Coagulación-Floculación Eficiencia Floculación, Coagulación, Sedimentación