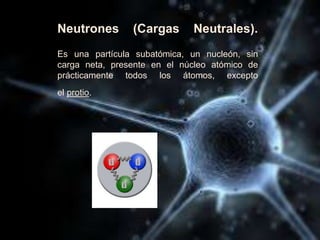
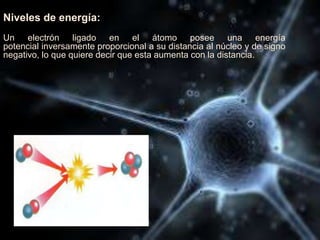
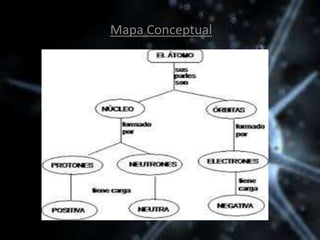
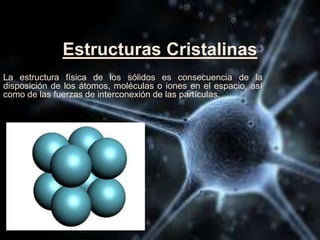
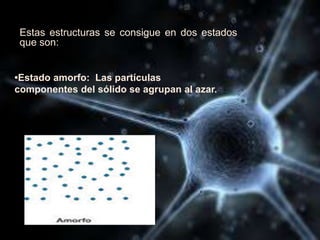
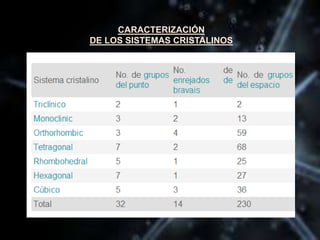
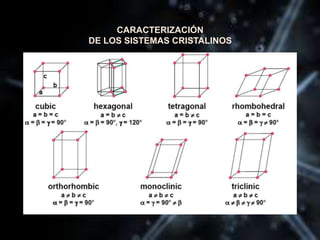
El documento describe las propiedades de los átomos y las estructuras cristalinas. Explica que los átomos están compuestos de protones, neutrones y electrones, y que han evolucionado desde conceptos filosóficos antiguos hasta modelos atómicos modernos. También describe las seis estructuras cristalinas principales y los tres tipos de cristales - iónicos, covalentes y metálicos - según el tipo de enlace atómico.