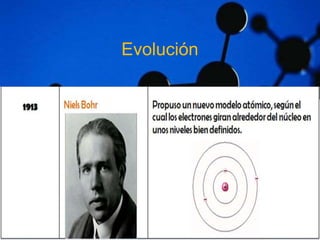
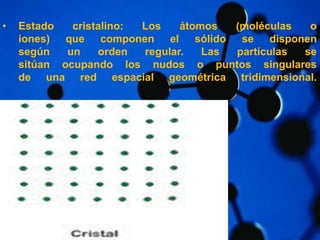
Este documento describe la estructura atómica y las estructuras cristalinas de los materiales. Explica que los átomos están compuestos de protones, neutrones y electrones, y que las estructuras cristalinas pueden ser amorfas o cristalinas, donde las partículas se disponen de forma ordenada en una red tridimensional. También distingue entre cristales iónicos, covalentes y metálicos según el tipo de enlace entre los átomos.