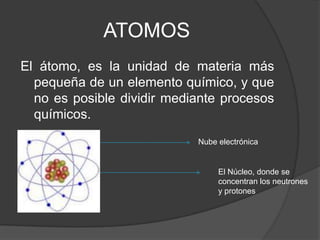
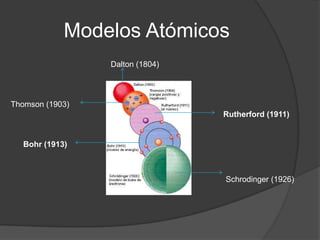
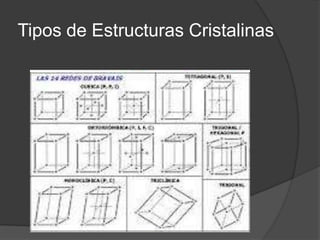
Este documento presenta información sobre la estructura atómica y las estructuras cristalinas. Explica los diferentes modelos atómicos a través de la historia, incluyendo los modelos de Dalton, Thomson, Rutherford, Bohr y Schrödinger. También describe las estructuras cristalinas y los siete sistemas cristalográficos, señalando que los átomos en un material cristalino se ordenan de manera repetitiva tridimensional.