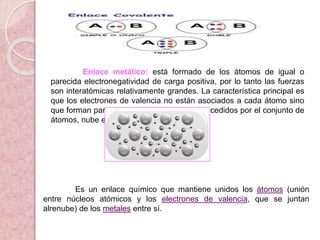
El documento resume conceptos fundamentales sobre la estructura atómica de la materia, incluyendo la composición del átomo, los orbitales atómicos, los enlaces químicos entre átomos (iónicos, covalentes y metálicos), las fuerzas intermoleculares y la estructura cristalina de los sólidos.