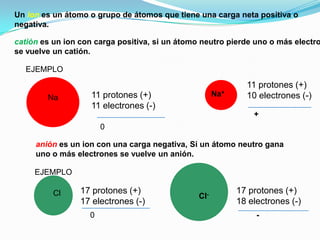
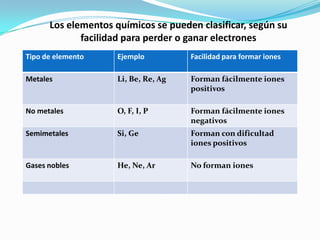
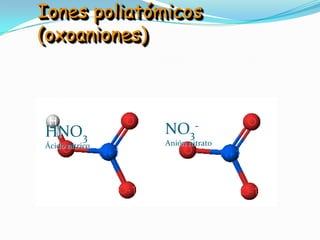
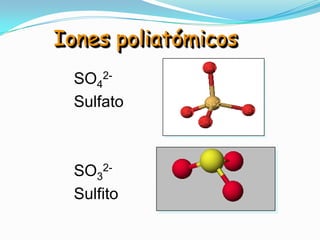
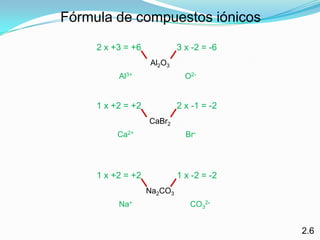
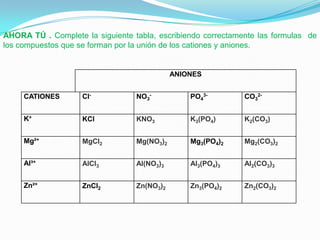
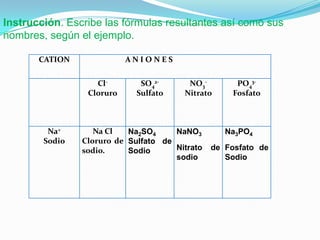
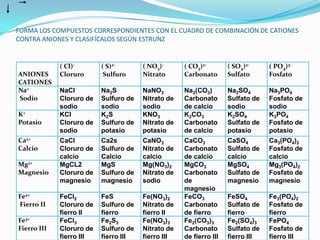
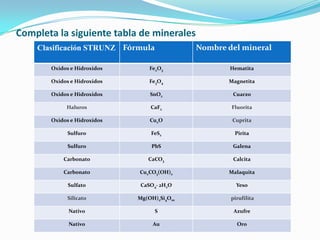
El documento describe la formación de minerales a través de la formación de iones y compuestos iónicos. Explica que los iones se forman cuando los átomos ganan o pierden electrones, convirtiéndose en cationes (carga positiva) o aniones (carga negativa). Luego, los compuestos iónicos se forman cuando los cationes y aniones se unen eléctricamente para formar sustancias químicas neutras. Proporciona ejemplos de diferentes tipos de iones y compuestos iónicos, y explica cómo se