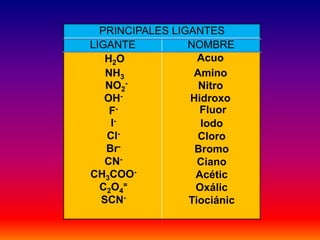
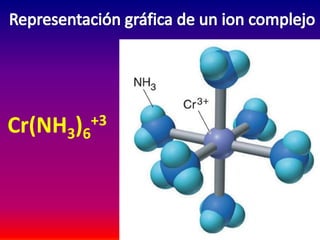
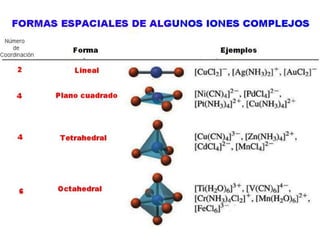
Este documento describe las reacciones de formación de iones complejos metálicos, incluyendo ejemplos como Cu+2 + 4NH3 = Cu(NH3)4+2 y Zn+2 + 4OH- = Zn(OH)4-2. Explica que los iones de transición forman los iones complejos más estables y que la carga del ion complejo es la suma de las cargas del catión y los ligantes. También resume la nomenclatura y estabilidad de los iones complejos.







![Cu+2 + 4NH3 = Cu(NH3)4
+2
Zn+2 + 4CN- = Zn(CN)4
-2
- Son reacciones de equilibrio
- Cumplen la LAM
Kf = 1,1.1013
Kf = 1,0.1018
Kf = Constante de formación (Tablas
25 °C)
25°C
Kf = [Cu(NH3)4
+2] = 1,1.1013
[Cu+2][NH3]4
Kf = [Zn(CN)4
+2] = 1,0.1018
[Zn+2][CN-]-4](https://image.slidesharecdn.com/08formaciondeionescomplejos-140514141433-phpapp01/85/08-formacion-de-iones-complejos-11-320.jpg)

![Continuación…..
Fe(CN)6
-4 = Fe+3 + 6CN-
C – xi xi 6xi
Ki = [Fe+3][CN-]6
[Fe(CN)6
-4]
xi (6 xi)6
(C - xi)
=
Ki = constante de inestabilidad
xi = cantidad inestable
C - xi = cantidad estable
Gi = xi . 100 , grado de inestabilidad.
C
Son inversas
Un ion complejo se considera estable si Ki < 10-8 o Kf > 108](https://image.slidesharecdn.com/08formaciondeionescomplejos-140514141433-phpapp01/85/08-formacion-de-iones-complejos-13-320.jpg)
![Ejercicio: En una solución de Ag(CN)2
- 0,01M, determinar la cantidad inestable y
estable, así como su grado de inestabilidad del ion complejo.
Solución
Ag(CN)2
- = Ag+ + 2CN-
C - xi xi 2xi
De la tabla:
Kf = 5,6.10¹⁸, entonces: Ki = 1/Kf = 1/5,6.1018 = 1,78.10-19.
1,78.10-19 = [Ag+][CN-]2 = xi (2xi)2
[Ag(CN)2
-] C - xi
Si C - xi = 0,01 - xi = 0,01 (despreciando xi)
1,78.10-19 = 4xi
3/0,01
xi = 7,6.10-8 M
Entonces:
Cantidad inestable = 7,6.10¯⁸ M.
Cantidad estable = 0,01 - 7,6.10-8 M.
Gi = 7,6.10-8 x 100 = 7,6.10-4 %
0,01](https://image.slidesharecdn.com/08formaciondeionescomplejos-140514141433-phpapp01/85/08-formacion-de-iones-complejos-14-320.jpg)
