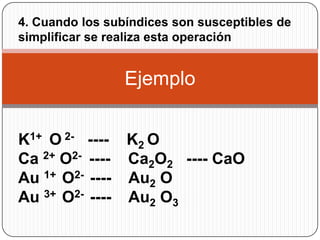
Este documento describe los óxidos básicos o metálicos, que son compuestos binarios formados por la unión de un metal con oxígeno. Explica cómo se representan los números de oxidación de cada elemento y cómo se formulan y nombran los óxidos según las nomenclaturas IUPAC y tradicional. Además, señala que algunos óxidos se han usado desde la Antigüedad para la preparación de pigmentos y la extracción de metales, y en la actualidad también tienen aplicaciones derivadas de sus propiedades físicas y