Celdas Galvánicas.pptx
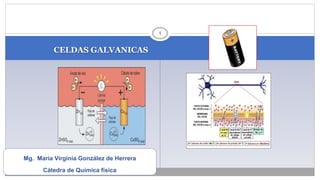
- 1. CELDAS GALVANICAS 1 Mg. María Virginia González de Herrera Cátedra de Química física
- 2. CELDAS VOLTAICAS Alessandro Volta: Italia (1745-1827) 1774: profesor de física en la Escuela Regia de Como. 1775 inventó el electróforo perpetuo, un instrumento que producía cargas eléctricas. 1800 ideó una pila hecha con discos de plata y discos de zinc, colocados de forma alterna y separados por discos de cartón mojados en salmuera. 2 Luigi Galvani: médico fisiólogo Italia, (1737-1798) 1790: el contacto de dos metales diferentes con el músculo de una rana originaba la aparición de una corriente eléctrica que provocaba la contracción muscular. Atribuyo esta electricidad a los nervios y a los músculos del animal, “electricidad animal” PILAS GALVANICAS
- 3. SISTEMAS ELECTROQUÍMICOS I. Celdas Electroquímicas, Galvánicas o Pilas voltaicas Generan energía eléctrica a partir de energía química. Rx espontánea II. Celdas o cubas electrolíticas o reactores Formación de sustancias químicas a partir de energía eléctrica suministrada. Rx No espontánea 3
- 4. CELDAS ELECTROQUÍMICAS Procesos involucrados: Rx química Transferencia de una especie química de un nivel de concentración a otro, etc. El requisito esencial; ser resultante de un proceso de oxidación y otro de reducción. 4 “ Arreglos experimentales que generan energía eléctrica a partir de una reacción química; o promueven una reacción química empleando energía eléctrica”.
- 5. CELDAS ELECTROQUÍMICAS El proceso es espontaneo y por tanto termodinámicamente irreversible. Para aplicar la termodinámica se debe lograr sistemas reversibles (proceso infinitamente lento) Las baterías o pilas, tienen más de 200 años de existencia, desde su primer modelo primitivo hasta los modernos productos, como pilas alcalinas, pilas recargables etc. 5
- 6. Oxidación- Reducción OXIDACIÓN: Pérdida de electrones (o aumento en el número de oxidación). : Cu Cu2+ + 2e– REDUCCIÓN: Ganancia de electrones (o disminución en el número de oxidación). : Ag+ + 1e– Ag Siempre que se produce una oxidación debe producirse simultáneamente una reducción Cada una de ellas se denomina semirreacción. 6
- 7. Reacciones Galvánicas Introducimos una barra de Zn en disolución de CuSO4 (Cu2+ + SO4 2–) se produce espontáneamente la siguiente Rx: El Zn se oxida (pierde e-) el Cu2+ se reduce (gana e-). Si las reacciones de oxidación y reducción se producen en recipientes separados, los electrones circularán: corriente eléctrica. 7 2 ) ( ) ( ) ( 2 ) ( aq S s aq Zn Cu Zn Cu
- 8. ELECTRODOS. Semiceldas o Hemiceldas, Una barra metálica sumergida en una disolución del mismo metal, es un electrodo. En la pila ubicamos dos electrodos: Ánodo: oxidación (-) En el ejemplo anterior sería el electrodo de Zn (Zn/ZnSO4). Cátodo: reducción (+) En el ejemplo anterior sería el electrodo de Cu (Cu/CuSO4). 8
- 9. Tipos de electrodos Según su constitución: Electrodos Gaseosos Electrodos metal-sal insoluble Electrodos metal-Ion metálico Electrodos de Concentración 9
- 10. ELECTRODOS GASEOSOS: Electrodo de Hidrógeno: H2(g)P=1 atm /HCl (aq)(1M) Constituido por una lámina de platino (Pt) sobre el que se burbujea H2 a P=1atm a través de una solución de HCl 1 M . Por convenio su fem (E) es cero voltios. E= 0,000 V, para [H+] = 1M. 10 Rx. Reducción: 2 H+ + 2 e– H2 Rx. Oxidación: H2 2 H+ + 2 e–
- 11. ELECTRODO METAL-SAL INSOLUBLE E. Cobre Nitrato de Plata Cu (s)/AgNO3 (aq) Barra de cobre en solución de AgNO3. Rx. Oxidación: Cu Cu2+ + 2e– Rx. Reducción: Ag+ + 1e– Ag 11 E. Zn (s)/ Pb(NO3)2 (aq) Lámina de zinc en una solución de Pb(NO3)2. La lámina de Zn se recubre de una capa de plomo: Rx. Oxidación: Zn Zn2+ + 2e– Rx. Reducción: Pb2+ + 2e– Pb
- 12. Electrodo. Metal/ Ácido E. Zn (s)/ HCl(aq) Al añadir HCl(aq) sobre Zn(s) se produce ZnCl2 y se desprende H2(g) , gas inflamable, produce una pequeña explosión al acercarle un cerilla encendida. Rx: Zn + HCl → ZnCl2 + H2↑ 12
- 13. PILA DE DANIELL Electrodo de Cobre Cu metálico en disolución de CuSO4 Cu0 (s) / CuSO4 (1M) Electrodo de Zinc Zn metálico en disolución de ZnSO4. Zno (s) / ZnSO4 (1M) Tabique poroso entre los dos electrodos 13
- 14. PILA DANIELL Las Semiceldas están unidas por un Puente salino que evita que se acumulen cargas del mismo signo en cada semicelda. Entre los electrodos se genera una: Diferencia de potencial: E, o fuerza electromotriz (fem) o voltaje en voltios (V), y se mide con un voltímetro. 14
- 15. NOMENCLATURA DE LA PILAS Línea Vertical: representa una interfase por ejemplo entre un solido y un liquido: Ej. Zn(s)І ZnSO4 Línea Vertical doble: representa unión entre dos soluciones mediante un puente salino. Ej. Zn(s)І ZnSO4 ║ CuSO4 І Cu(s) Línea vertical punteada: representa la unión entre dos soluciones mediante una membrana permeable H2(1 atm)| HCl(m1) ¦ HCl(m2) | H2(0.5 atm) pila de concentración Cuando existe un conductor inerte se antepone al par redox y de existir un gas se pone a continuación la presión correspondiente. Ej. Pt,H2 (1 atm) |HCl (m1) Convención: el electrodo de la izquierda representa la oxidación (ánodo) y el de la derecha representa la reducción (cátodo) 15
- 16. REPRESENTACIÓN ESQUEMÁTICA DE UNA PILA, SEGÚN LA NOMENCLATURA CONVENCIONAL La pila anterior se representaría: Zn (s) ZnSO4 (aq) CuSO4 (aq) Cu (s) (-)Ánodo Puente salino Cátodo (+) Rx: Ánodo (oxidación): Zn – 2 e– Zn2+. Cátodo reducción: Cu2+ + 2 e– Cu 16 ↑
- 17. Pilas primarias y secundarias Pilas primarias: Reacción química irreversible, y por lo tanto, no recargable (posee un sólo ciclo de vida). Ej. Zinc Carbón, Zinc Chloride, Alcalinas Pilas secundarias: Reacción química reversible, se pueden recargar para volver a utilizarlas, las pilas recargables funcionan con una reacción química reversibles lo cual permite recargarlas repetidas veces. Posee ciclos de vida múltiples. Ej. NiCd, NiMh, Li ion. No contienen mercurio, pero el cadmio es un metal con características tóxicas. 17
- 19. Diferencia de Potencial de una pila :Epila Fuerza electromotriz (Epila), diferencia entre Potenciales de reducción de los electrodos. Cada semireacción tiene un potencial de reducción. Reacciones catódicas reducción; el potencial de reducción siempre será mayor Reacciones anódicas oxidación; el potencial de oxidación siempre será mayor Potencial de Reducción Cada pareja oxidante-reductora tendrá mayor o menor tendencia a estar en su forma oxidada o reducida. Que se encuentre como oxidante o reductor dependerá de cómo esta conformada la pareja. ¿Qué especie se reducirá? Aquella que tenga un mayor potencial de reducción. Los valores se hallan en tablas. 19 ánodo cátodo pila E E E
- 20. 20 Tabla1: Potenciales de Reducción Electródico
- 21. 21 Tabla de Potencial de Reducción Electródico
- 23. Ejemplo: ¿Será espontánea la siguiente reacción redox? Cl2(g) + 2 I– (aq) 2Cl– (aq) + I2 (s) La reacción dada es la suma de las siguientes semirreacciones: Red. (cátodo): Cl2(g) + 2e– 2Cl–(aq) Oxid. (ánodo): 2 I–(aq) I2 (s) + 2e– Para que la reacción sea espontánea tiene que cumplirse que: Epila > 0: Epila = Ecatodo – Eánodo = +1.36 V – 0.54 V = +0.72 V > 0 luego es espontánea (las moléculas de Cl2 tienen más tendencia a reducirse que las de I2). 23
- 24. Ejercicio : Una pila: electrodo de Mg introducido en una disolución 1 M de Mg(NO3)2 y un electrodo de Ag en una disolución 1 M de AgNO3 . ¿Qué electrodo actuará de cátodo y de ánodo y cuál será el voltaje de la pila correspondiente? ¿Qué especie se reduce? La que tenga mayor potencial de reducción. En este caso la Ag (+0,80 V) frente a los –2,37 V del Mg. Red. (cátodo): Ag+(aq) + 1e– Ag(s) Oxid. (ánodo): Mg(s) Mg2+(aq) + 2e– Epila = Ecatodo – Eánodo = +0,80 V – (–2,37 V) Epila = 3,17 V 24
- 26. Termodinámica de las pilas Energía libre (ΔG)y Entalpía (ΔH): Reacción general para una pila galvánica reversible: aA + bB + . . . ↔ cC + dD +. . . Q, coeficiente de reacción cuando el sistema esta en un punto diferente al equilibrio , ΔG0 : Energía libre standard El cambio de Energía libre total (ΔG ): ΔG = ΔH – TΔS La energía libre de Gibbs (∆G) involucra los contenidos energéticos de las especies presentes en sus estados de referencia 26 b B a A d D c C a a a a Q . . b B a A d D c C a a a a RT G G . . ln 0
- 27. Energía libre (ΔG) y Entalpía (ΔH) Donde: ΔG = cambio de energía libre de reacción ΔH=cambio de entalpía de reacción ΔS =cambio de entropía de reacción μi =potencial químico de la especie i μi o = potencial químico en estado estandar, eso es cuando la actividad fixi = 1 fi = coeficiente de actividad de especie i xi = fracción molar de la especie i νi = coeficiente estequiométrico de la especie i 27 ΔG = ΔH – TΔS = ∑ν i μ i = ∑νi μi o + RT ∑νi ln f i x i
- 28. En el estado estandar (actividades igual a 1) ΔGo= ΔHo– TΔSo = ∑νi μio A partir de la Iy II leyes de la termodinámica, se demuestra que el trabajo máximo útil Wmax para un proceso isotérmico de la celda galvánica que trabaja a presión constante es igual al cambio de energía del sistema dG dG = dH – TdS Y El cambio de energía interna: dU = dQ – dw = dQ – (pdV + dWmax) (6) Donde: pdV =trabajo de expansión. Y dWmax = trabajo útil máximo 28
- 29. Dependencia de E con la temperatura 29
- 30. La energía eléctrica producida por una pila ( o un circuito de pilas) que trabajan reversiblemente es igual al trabajo útil W del proceso total, considerada la pila como un sistema termodinámico. Trabajo útil (W ) del proceso reversible es máximo e igual a la disminución del potencial isobárico del sistema – ΔG. Energía libre de Gibbs (ΔG) : una reacción con especies en solución, se genera una diferencia de potencial (E) que promueve el transporte de partículas cargadas y se expresa por la relación: E, diferencia de potencial eléctrico n, numero de electrones, F , constante de Faraday, 96 500 Coulumbs, nF, cantidad de carga que se puede transportar debido a esa diferencia de potencial. 30 W = – ΔG ΔG = – nFE Trabajo útil (W) y Energía libre de Gibbs (ΔG) :
- 31. Energía libre de Gibbs (ΔG) y Ecuación de Nernst ( E ): Un proceso espontáneo ocurre con una reducción de energía libre de Gibbs. La electroquímica define la partículas móviles responsables de la aparición de la corriente eléctrica como transportadores de cargas eléctricas negativas. Las cargas se mueven en un campo con potencial positivo (voltios). El (∆G°) involucra los contenidos energéticos de las especies en sus estados de referencia y Q, cociente entre las cantidades de sustancia presentes en un caso particular. 25°C la ecuación de Nernst puede escribirse explícitamente como: RT/F equivale a 0.0591 31 G b B a A d D c C a a a a RT G G . . ln 0 Q n E E o ln 0591 . 0 b B a A d D c C o a a a a n E E . . ln 0591 . 0 reduccion oxidacion a a n ln 0591 . 0
- 32. Potencial estándar de una pila (E°) 32
- 33. Pilas de concentración Están conformadas por dos electrodos iguales separados por un tabique poroso y con distintas concentraciones de sus iones. Aparece una diferencia de potencial entre ellos; el ánodo es el electrodo de menor concentración La f.e.m.(E) es consecuencia de la diferencia existente entre las actividades de las dos disoluciones, formadas por la misma sustancia, en cada uno de los semielementos. 33
- 34. Medición de E Voltímetro Galvanómetro Se basan en las interacciones entre una corriente eléctrica y un imán Puente de Wheaston Las mediciones más precisas de la resistencia se obtienen con un circuito llamado puente de Wheatstone, en honor del físico británico Charles Wheatstone. Este circuito consiste en tres resistencias conocidas y una resistencia desconocida, conectadas entre sí en forma de diamante 34
- 35. Patrones de Voltaje: celda patrón Por muchos años el voltio patrón se basó en una celda electroquímica llamada celda patrón saturada o celda patrón. La celda saturada es dependiente de T y el voltaje de salida cambia - 40 de 1.01858 V. Hay dos tipos de celda Weston: la celda saturada, en la cual el electrolito está saturado a todas las temperaturas por los cristales del sulfato de cadmio que cubren los electrodos, y la celda no saturada, en la cual la concentración de sulfato de cadmio produce saturación a 4 grados C. 35
- 36. PILA PATRÓN DE WESTON En 1893, por Weston, la pila que se eligió en 1908 como patrón de fuerza electromotriz. Con un E =1,0186 V a 20 °C, casi independiente de la T El ánodo(-) amalgama de mercurio metálico y cadmio, El cátodo(+) mercurio puro, en una solución saturada de sulfato de cadmio y una pasta de sulfato de mercurio I como el despolarizador. Cuando la solución de electrólito está saturada el voltaje de la celda es muy reproducible, de ahí su uso como un estándar. 36 mercurio metálico solución saturada de sulfato de cadmio pasta de sulfato de mercurio I. Cristales de sulfato de cadmio amalgama de mercurio metálico y cadmio, Cristales de sulfato de cadmio
- 37. Potencial de membrana Potencial de membrana, voltaje diferencia del potencial eléctrico a ambos lados de la membrana plasmática de una célula. La membrana de las células está polarizada, por el reparto desigual de cargas eléctricas entre el interior y el exterior de la célula. diferencia de potencial, siendo el exterior positivo respecto al interior. Potencial de Nernst El potencial de reposo de una célula es producido por diferencias en la concentración de iones dentro y fuera de la célula y por diferencias en la permeabilidad de la membrana celular a los diferentes iones. El potencial de equilibrio de Nernst relaciona la diferencia de potencial a ambos lados de una membrana biológica en el equilibrio con las características relacionadas con los iones del medio externo e interno y de la propia membrana. 37
- 38. Impulso nervioso El potencial de membrana oscilan entre -50 y 60mV. En el líquido intersticial, el anión más abundante es el de Cl-. En el citoplasma, los aniones más abundantes son las proteínas, que a pH celular se ionizan negativamente. El catión más abundante en el líquido intersticial es el de Na+, y en el citoplasma l de K+. El desequilibrio iónico produce la polarización de la membrana, debido a la distinta permeabilidad que presenta frente a cada uno de los iones. El K+ atraviesa la membrana libremente. La permeabilidad para el Na+ es menor, y además es expulsado por medio de un transporte activo llamado bomba de sodio - potasio. Las proteínas, debido a su tamaño, no pueden atravesar libremente la membrana. Toda esta dinámica establece una diferencia de potencial en reposo, de -90mV. La existencia de este potencial de membrana es imprescindible para el origen y transmisión del impulso nervioso. 38
- 39. Transmisión Eléctrica en nuestro cuerpo Las células tienen una corriente eléctrica causadas por iones que afectan el metabolismo y el trabajo de la célula. El movimiento de iones es fundamental para los latidos del corazón, contracción muscular y el desenlace de una respuesta inmune. Las señales eléctricas que usa el cerebro para la comunicación entre neuronas son originadas por movimientos de iones. Los iones fundamentales para la propagación de señales eléctricas en el cerebro son sodio (Na+), potasio (K+), cloro (Cl-) y calcio (Ca++). Transmición de una señal eléctrica en la neurona es mediante cambios de potencial eléctrico. El potencial eléctrico interno de la célula es -70 mV, el potencial eléctrico fuera de la célula es “cero”, pero crece hasta +40 mV luego de un estímulo ordenado por nuestro cerebro para provocar una acción muscular. 39 Estos fenómenos ocurren debido al intercambio de iones de Na+ y K+, entre fuera y dentro de la célula. Pero los iones son incapaces de pasar a través de la membrana ya que ésta actúa como un aislante eléctrico. Los llamados canales iónicos. Estas son proteínas embebidas en la membrana con agujeros muy pequeños a través de los cuales pueden pasar los iones.
- 40. ELECTRODOS PARA USO EN ESTUDIO DE ELECTROFISIOLOGÍA 40
- 41. Potenciometría O pH-metro, el sistema actúa como pila, mide ΔV. Al sumergir los dos electrodos en la solución se establece un flujo de iones en la interfase entre la membrana selectiva y la solución de trabajo, produciéndose una fem, cuya magnitud depende de la cantidad de iones presente en la solución. La Fem se transforma en pH. 41
- 42. En USA, avances en materia de energía solar que cambiarían el curso de la historia. El sistema "fotovoltaico concentrado“ puede producir tanta energía como paneles mucho más grandes, gracias a unos lentes que incrementan la luz solar 2.000 veces. El precio por kilovatio/hora sería de 7 centavos de dólar, y se supoene que estariá disponible para mediados del 2009. 42 Las pilas solares generan electricidad por conversión fotoeléctrica. La fuente de electricidad, semiconductor fotosensible (cristal de silicio) con impurezas. La luz incide contra el cristal, los e- se liberan de la superficie y se dirigen a la superficie opuesta. Allí se recogen como corriente eléctrica. Tienen una vida muy larga y se utilizan en los aviones como fuente de electricidad para el equipo de a bordo. PILAS SOLARES
- 43. Pilas Contaminante s peligrosos Contienen : mercurio, cadmio, zinc, plata y plomo, metales pesados. Una vez agotadas, continúan produciendo óxidos metálicos tóxicos . Contaminan suelo y agua afectando toda forma de vida. Contaminan la cadena alimentaría; Pila de Hg contamina alrededor de 600.000 litros de agua, al liberar sus componentes de mercurio o cadmio, los que entran en contacto con la tierra,. Medidas: es utilizar pilas libre de mercurio o pilas recargables. Juntarlas, encapsularlas con un material que las neutralice químicamente y que retenga, por solidificación, los productos metálicos. Es un problema comunitario frenar la contaminación!!!!! 43
- 44. Electrólisis Cuando la reacción redox no es espontánea en un sentido, podrá suceder si desde el exterior se suministran los electrones. En el ejercicio D anterior en el que el electrodo de Magnesio hacía de ánodo y se oxidaba frente al de plata que hacía de cátodo formando una pila de f.e.m = 3,17 V, Se puede forzar la formación de Mg(s) (reducción) si desde el exterior se suministran los 3,17 V que se necesitan vencer (por ejemplo usando una pila que proporcione mayor voltaje). 44
- 45. Leyes de Faraday de la Electrólisis I ley: El cambio químico producido es proporcional a la carga de electricidad (Q) que pasa por la celda. II ley: La carga requerida para depositar o liberar una masa m viene dada por la ley de Faraday. 45 “
- 46. Ley de Faraday n M Q n QM n QM F n QM qN N M qn Q m A A . 96485 . . 96485 1 . 1 . 1 . 46 m, masa de la sustancia producida en el electrodo (g), Q, carga eléctrica total que pasó por la solución (C) q, es la carga del electrón = 1.602 x 10-19 culombios por electrón, n, número de valencia de la sustancia como ion en la solución (electrones por ion), F = qNA = 96485 C·mol-1 es la Constante de Faraday, M, es la masa molar de la sustancia (en gramos por mol), y NA es el Número de Avogadro = 6.022 x 1023 iones por mol.
- 47. Electrólisis del agua El oxígeno se produce en el ánodo y hidrógeno en el cátodo: 2 OH- → H2O + 1/2 O2 + 2e ÁNODO 2H2O + 2e → H2 + 2 OH- CÁTODO H2O → H + 1/2O2 Rx GLOBAL 47
- 48. PROCESOS ELECTROQUIMICOS IMPORTANTES Galvanizado Consiste en recubrir con una capa de zinc las piezas de hierro, que se oxidan fácilmente. Reacción cátodica: reducción de los iones Zn2+ a Znº : se da el recubrimiento metálico. 48 plateado de una llave
- 49. Aplicaciones de la electrólisis. 49 Electrorrefinado del Cu. Electrodeposición de Ag.
- 50. Polaridad de electrodos en pilas y c. electrolíticas 50
- 52. necesita un mantenimiento cada 7 años. Se gastan 70 Toneladas de pintura Se deben pintar 200000m2 de superficie. Si se hubiera pintado después de un galvanizado se ahorrarían 10 millones de euros cada 7 años. 52 La Torre Eiffel