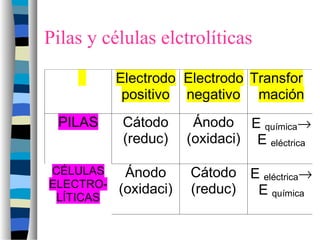
Este documento resume conceptos clave sobre reacciones redox, incluyendo la oxidación y reducción desde perspectivas clásica y electrónica, números de oxidación, agentes oxidantes y reductores, pares redox, métodos para ajustar reacciones redox, electroquímica, pilas galvánicas, potenciales de reducción estándar, electrólisis, leyes de Faraday, corrosión y especies redox comunes.