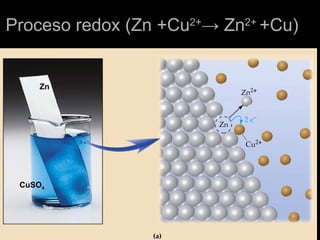
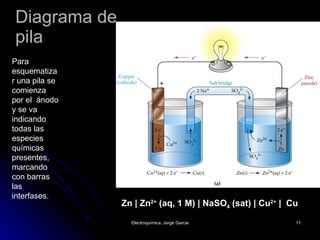
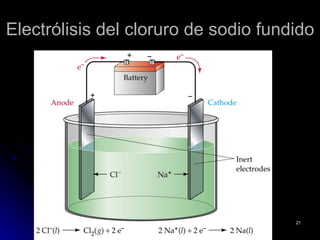
El documento define la electroquímica como la parte de la química que estudia la interconversión entre energía eléctrica y química. Explica que en las celdas galvánicas se obtiene energía eléctrica de una reacción química espontánea, mientras que en las celdas electrolíticas se usa energía eléctrica para causar una reacción no espontánea. También describe los conceptos básicos de oxidación, reducción y potencial de electrodo estándar, y cómo se usan para calc