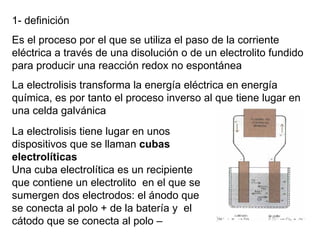
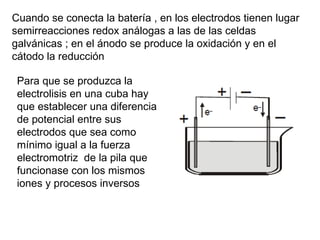
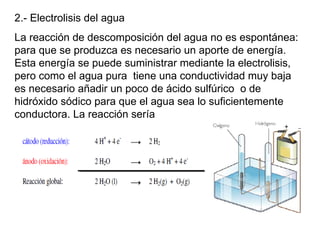
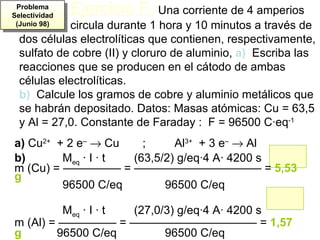
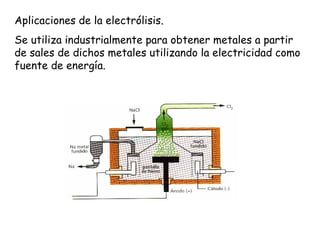
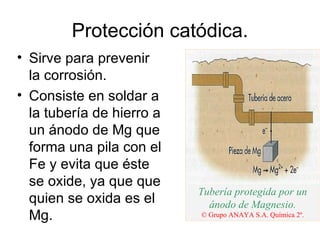
La electrolisis es el proceso por el cual se utiliza la corriente eléctrica para producir una reacción redox no espontánea en un electrolito. Ocurre en cubas electrolíticas que contienen un electrolito y dos electrodos conectados a una fuente de voltaje. En los electrodos tienen lugar semirreacciones redox, con oxidación en el ánodo y reducción en el cátodo. La electrolisis transforma energía eléctrica en química y se usa industrialmente para obtener metales puros.