Este documento describe las características de los ácidos y las bases, así como algunas definiciones clave relacionadas con ellos. En primer lugar, se describen las propiedades de los ácidos y las bases, como su sabor, corrosividad y efectos sobre indicadores de pH. Luego, se resumen las teorías de Arrhenius, Brønsted-Lowry y Lewis sobre la naturaleza química de los ácidos y las bases. Finalmente, se explican conceptos como el pH, las disoluciones ácidas y básicas, y los























![.
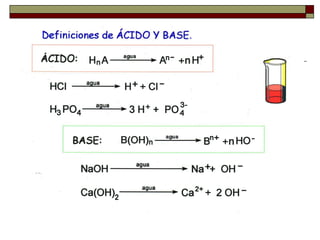
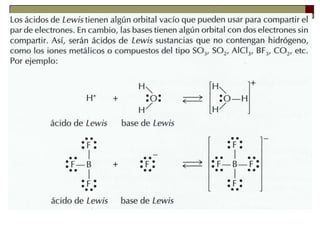
– Acido es una sustancia que puede aceptar un par de
electrones. Es lo que hemos llamado electrófilo.
– Base es una sustancia que puede donar, o compartir, un par
de electrones. Es lo que hemos llamado nucleófilo.
BF3 + F- ( BF4 )-
(ácido) (base)
Ag+ + 2 CN- [Ag (CN)2 ]-
(ácido) (base)](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-26-320.jpg)


![30
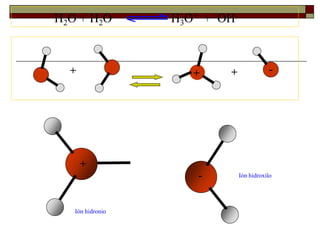
Equilibrio de ionización del agua.
La experiencia demuestra que el agua tiene una
pequeña conductividad eléctrica lo que indica que
está parcialmente disociado en iones:
2 H2O (l) H3O+(ac) + OH– (ac)
H3O+ · OH–
Kc = ——————
H2O2
Como H2O es constante por tratarse de un
líquido, llamaremos Kw = Kc · H2O2
[ ]×[ ] -
w 3 K H O OH
conocido como “producto iónico del agua”](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-30-320.jpg)
![31
Concepto de pH.
El valor de dicho producto iónico del agua es:
KW (25ºC) = 10–14 M2
En el caso del agua pura:
———–
H3O+ = OH– = 10–14 M2 = 10–7 M
Se denomina pH a:
3 pH log [H O ]
para el caso de agua pura, como H3O+=10–7 M
pH = – log 10–7 = 7](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-31-320.jpg)



![35
Concepto de pOH.
A veces se usa este otro concepto, casi
idéntico al de pH:
pOH log [OH ]
Como Kw = H3O+ · OH– = 10–14 M2
Aplicando logaritmos y cambiando el signo
tendríamos:
pH + pOH = 14
para una temperatura de 25ºC.](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-35-320.jpg)

![Ejercicio A: Una disolución de ácido sulfú-rico tiene
una densidad de 1,2 g/ml y una riqueza del 20 % en
peso. a) Calcule su concentración expresada en
moles/litro y en gramos/litro. b) Calcule el pH de una
disolución preparada diluyendo mil veces la anterior.
37
Problema de
Selectividad
(Marzo 97)
a) ms ms % = —— x 100 = ——— x 100
mdn Vdn x d
ms % x d 20 x 1,2 g
conc (g/L) = —— = —— = ————— = 240 g/L
Vdn 100 10–3 L x 100
ns ms conc(g/L) 240 g/L
Molaridad = —— = ——— = ———— = ————
Vdn Vdn x Ms Ms 98 g/mol
Molaridad = 2,45 mol/L
b) pH = –log [H3O+] = –log (2 x 2,45x10–3 M) = 2,35](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-37-320.jpg)

![39
Electrolitos fuertes y débiles
Ácido fuerte
[A–] [H+]
[A–] [H+]
[HA] [HA]
[HA]
Ácido débil](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-39-320.jpg)

![41
Fuerza de ácidos.
En disoluciones acuosas diluidas (H2O
constante) la fuerza de un ácido HA depende
de la constante de equilibrio:
HA + H2O A– + H3O+
A– · H3O+ A– · H3O+
Kc = —————— Kc · H2O = —————
—
HA · H2O HA
A H O
3
K H O K
2
[ ] [ ]
[ ]
C [ HA
] a
constante de
disociación
(K acidez)](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-41-320.jpg)


![Ejemplo: Sabiendo que las constantes de acidez del
ácido fosfórico son: Ka1 = 7,5 x 10–3, Ka2 = 6,2 x 10–8 y
Ka3 = 2,2 x 10–13, calcular las concentraciones de los
iones H3O+, H2PO4
K M
44
–, HPO4
2– y PO4
3– en una disolución
de H3PO4 0,08 M.
Equilibrio 1: H3PO4 + H2O H2PO4
– + H3O+
c. in.(mol/l): 0,08 0 0
c. eq.(mol/l): 0,08 – x x x
[ ] [ ]
H PO H O x
2 4 3 3
x = 0,021
2
1
3 4
7,5 10
[ ] 0,08 a
H PO x
2 4 3 [H PO ] [H O ] 0,021M](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-44-320.jpg)
![2
4 3 8
K M
[ ] [ ] (0,021 ) 0,021
H PO H O z z z
; 3 4 3 13
K M
45
Equilibrio 2: H2PO4
– + H2O HPO4
2– + H3O+
c. in.(mol/l): 0,021 0 0,021
c. eq.(mol/l): 0,021 – y y 0,021 + y
[ ] [ ] (0,021 ) 0,021
HPO H O y y y
y = 6,2 x 10–8 M
Equilibrio 3: HPO4
2– + H2O PO4
3– + H3O+
c. in.(mol/l): 6,2 x 10–8 0 0,021
c. eq.(mol/l): 6,2 x 10–8– z z 0,021 + z
2 2 8 8
z = 6,5 x 10–19 M
;
2
2 4
6,2 10
a
[ H PO ] 0,021 y
0,021 2 8
4 [HPO ] 6,2 10 M
4
2,2 10
a
[ HPO ] 6,2 10 z
6,2 10 3 19
4 [PO ] 6,5 10 M](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-45-320.jpg)
![46
Fuerza de bases.
En disoluciones acuosas diluidas (H2O
constante) la fuerza de una base BOH
depende de la constante de equilibrio:
B + H2O BH+ + OH–
BH+ x OH– BH+ x OH–
Kc = —————— Kc x H2O = —————
—
B x H2O B
[ BH ] [ OH
]
K [ H O ]
K
2
C [ B
] b
(K basicidad)](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-46-320.jpg)





![52
Relación entre la constante
y el grado de disociación “”
En la disociación de un ácido o una base
A H O c c c
Igualmente:
En el caso de ácidos o bases muy débiles
(Ka/c o Kb/c < 10–4), se desprecia frente
a 1 con lo que: Ka = c 2 (Kb = c 2 )
De donde:
b
c
K
2
1
2
3
1 1
[ ] [ ]
[ ] ( - ) a
K
HA c
a K
b K
c
c
](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-52-320.jpg)
![Ejemplo: Una disolución de HBO2 10-2 M
tiene un de pH de 5,6. a) Razone si el ácido y su base
conjugada serán fuertes o débiles. b) Calcule la constante de
disociación del ácido (Ka). c) Cal-cule, si es posible, la
constante de basicidad del ion borato (Kb). d) Si 100 ml de
esta disolución de HBO2 se mezclan con 100 ml de una
disolución 10-2 M de hidróxido sódico, ¿qué concentración
de la base conjugada se obtendrá?
53
a) [H3O+] = 10–pH = 10–5,6 = 2,51 x 10–6 M
=[HO+]/c = 2,51 x 10–6 M/ 10-2 M = 2,51 x10–4
3lo que significa que está disociado en un 0,025 %
luego se trata de un ácido débil. Su base conjugada,
BO–, será pues, relativamente fuerte.
2
b) Ka = c x 2 = 10-2 M x(2,51 x 10–4)2 = 6,3 x 10–10
c) Kb = Kw/Ka = 10–14/ 6,3 x 10–10 = 1,58 x 10–5
d) Se neutralizan exactamente: [BO2
–] = 5 x 10–3 M
Problema de
Selectividad
(Marzo 98)](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-53-320.jpg)
![54
matraces, uno conteniendo 15 ml de HCl cuya
concentración es 0,05 M y el otro 15 ml de ácido etanoico
(acético) de concentración 0,05 M
a) Calcule el pH de cada una de ellas. b) ¿Qué cantidad de
agua se deberá añadir a la más ácida para que el pH de las dos
disoluciones sea el mismo? Dato: Ka (ácido etanoico) = 1,8 x
10-5
a) HCl es ácido fuerte luego está totalmente disociado,
por lo que [H3O+] = 0,05 M
pH = –log [H3O+] = –log 0,05 = 1,30
CH3COOH es ácido débil por lo que:
Ka 1,8 ·10-5 M
= —— = ————— = 0,019
c 0,05 M
[H3O+] = c = 0,05 M x 0,019 = 9,5 x 10-4 M
pH = –log [H3O+] = –log 9,5 x 10-4 = 3,0
Problema
Selectividad
(Junio 98)](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-54-320.jpg)
![55
matraces, uno conteniendo 15 ml de HCl cuya
concentración es 0,05 M y el otro 15 ml de ácido etanoico
(acético) de concentración 0,05 M
a) Calcule el pH de cada una de ellas. b) ¿Qué cantidad de
agua se deberá añadir a la más ácida para que el pH de las dos
disoluciones sea el mismo? Dato: Ka (ácido etanoico) = 1,8 x
10-5
b) n (H3O+) en HCl = V x Molaridad = 0,015 l x 0,05 M =
= 7,5 x 10-4 mol.
Para que el pH sea 3,0 [H3O+] = 10-3 M que será también
la [HCl] ya que está totalmente disociado.
El volumen en el que deberán estar disueltos estos moles es:
V = n/Molaridad = 7,5 x 10-4 mol/ 10-3 mol·l-1 = 0,75 litros
Luego habrá que añadir (0,75 – 0,015) litros = 735 ml
Problema
Selectividad
(Junio 98)](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-55-320.jpg)














![72
Indicadores de pH
(ácido- base)
Son sustancias que cambian de color al
pasar de la forma ácida a la básica:
HIn + H2O In– + H3O+
forma ácida forma básica
El cambio de color se considera apreciable
cuando [HIn] > 10·[In–] o [HIn]< 1/10·[In–
]
In– · H3O+ HIn
Ka = —————— H3O+ = Ka · ———
HIn In–](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-70-320.jpg)




![77
Valoraciones ácido-base
Vácido x [ácido] x a = Vbase x [base] x b
Todavía se usa mucho la concentración
expresada como Normalidad:
Normalidad = Molaridad x n (H u OH)
Vácido x Nácido = Vbase x Nbase
En el caso de sales procedentes de ácido o
base débiles debe utilizarse un indicador
que vire al pH de la sal resultante de la
neutralización.
Simulación](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-75-320.jpg)
![78
Ejemplo: 100 ml de una disolución de H2SO4 se
neutralizan con 25 ml de una disolución 2 M de
Al(OH)3 ¿Cuál será la [H2SO4]?
3 H2SO4 + 2 Al(OH)3 3SO4
2– +2Al3+ + 6 H2O
25 ml x 2 M x 3 = 100 ml x Mácido x 2
De donde:
25 ml x 2 M x 3
Mácido = ——————— = 0,75 M
100 ml x 2
[H2SO4] = 0,75 M
Vácido x Nácido = Vbas x Nbase (Nbase= 3 x Mbase)
100 ml x Nácido = 25 ml x 6 N
Nácido = 1,5 N Mácido= Nácido/2 = 0,75
M
Vídeo](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-76-320.jpg)
![79
Ejemplo: 100 ml de una disolución de H2SO4 se
neutralizan con 25 ml de una disolución 2 M de
Al(OH)3 ¿Cuál será la [H2SO4]?
Podríamos haber calculado n(H2SO4) a
partir del cálculo estequiométrico, pues
conocemos
n(Al(OH)3 = V· M = 25 ml · 2 M = 50
mmoles
3 H2SO4 + 2 Al(OH)3 3SO4
2– +2Al3+ + 6 H2O
3 mol H2SO4 2 mol Al(OH)3 ————— = ——————
n(H2SO4) 50 mmoles
n(H2SO4) = 75 mmol
n (H2SO4) 75 mmol
[H2SO4] = ————— = ———— = 0,75 M](https://image.slidesharecdn.com/acidobase-140914193312-phpapp02/85/ppt-acido-base-77-320.jpg)
