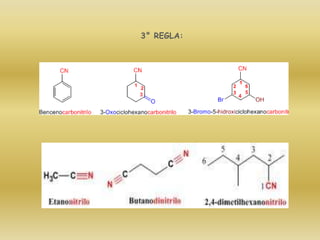
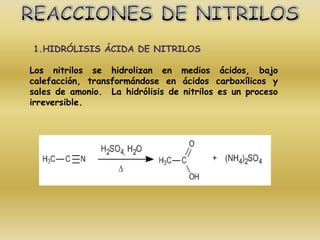
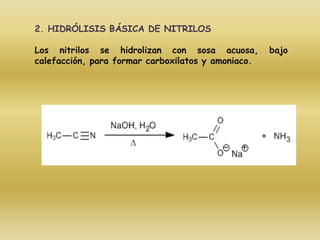
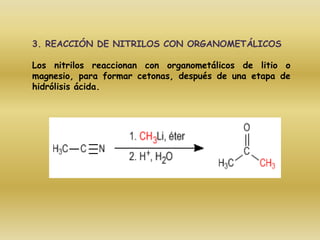
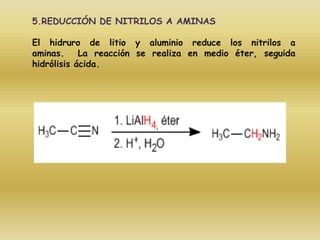
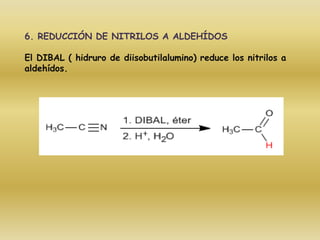
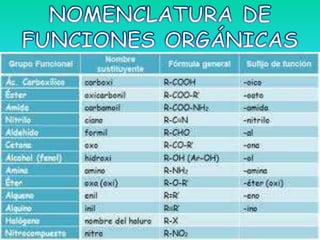
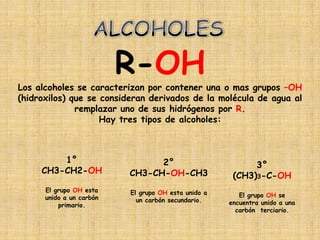
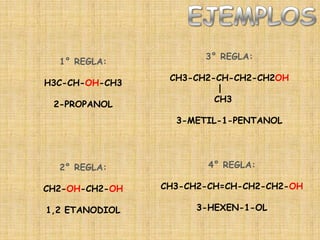
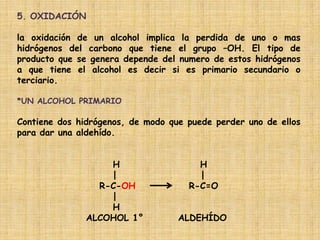
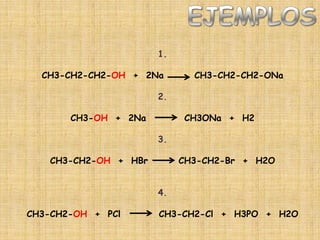
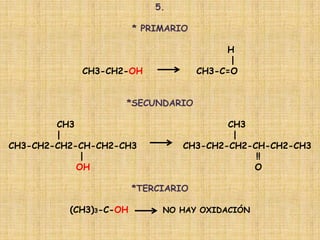
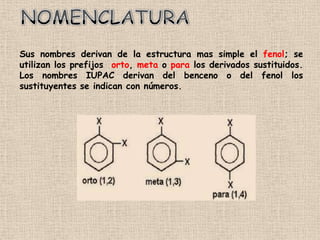
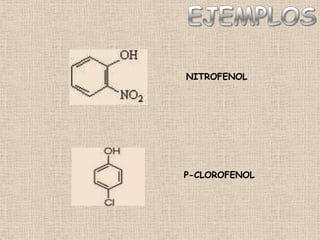
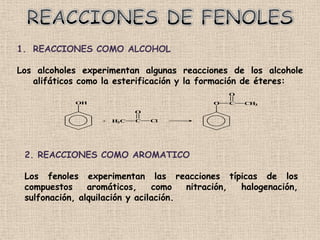
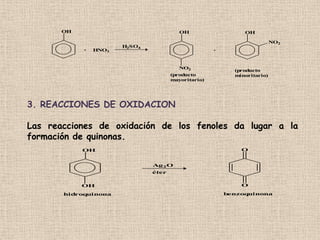
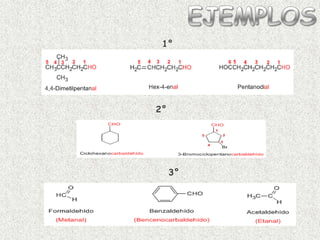
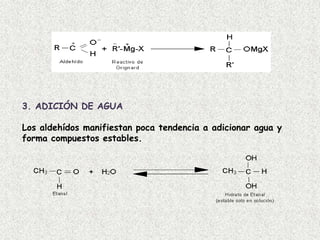
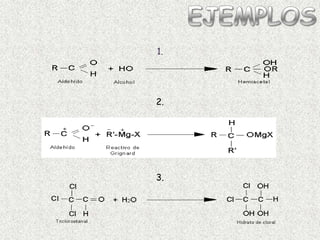
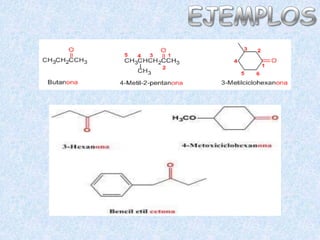
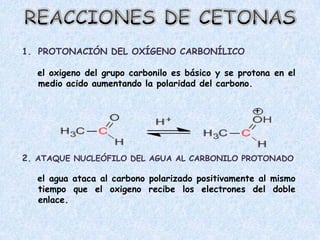
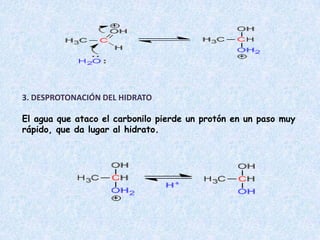
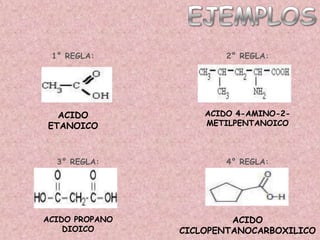
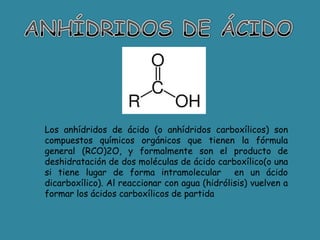
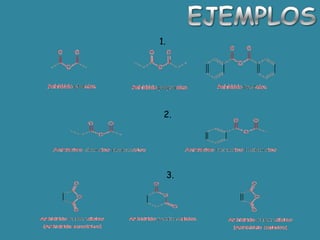
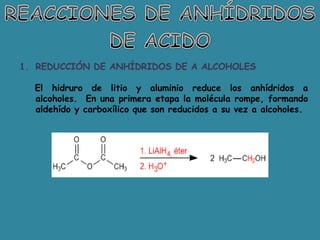
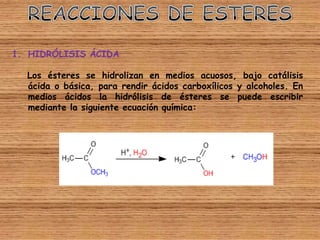
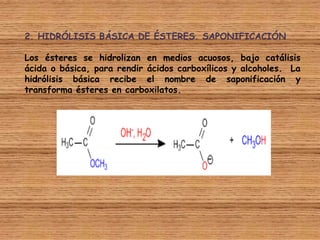
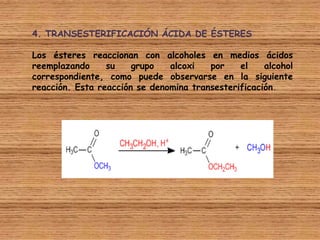
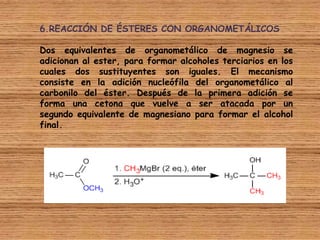
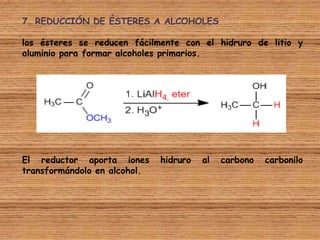
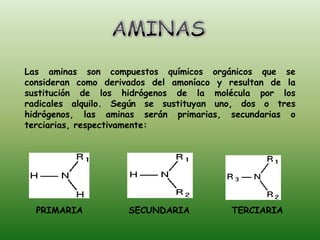
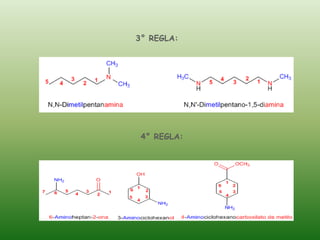
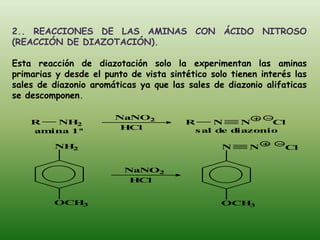
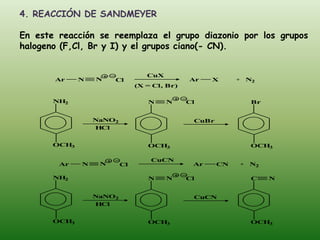
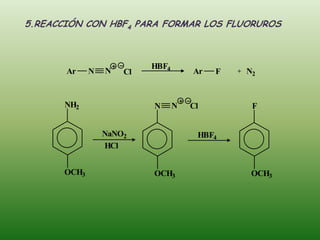
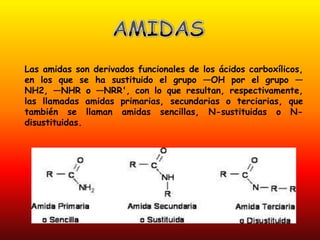
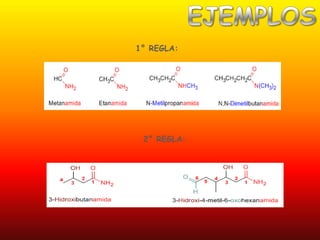
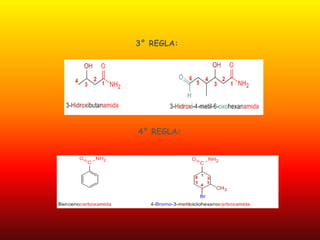
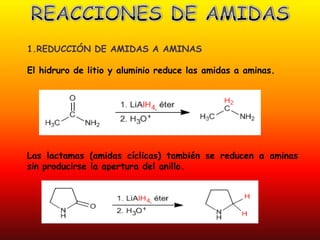
El documento detalla la química de las funciones oxigenadas, incluyendo alcoholes, aldehídos, cetonas, y ácidos carboxílicos, así como sus propiedades, nomenclatura y reacciones. Se explican las características de cada grupo funcional, las reglas para nombrarlos y sus reacciones químicas importantes, como la oxidación y la formación de ésteres. Además, se aborda la síntesis y las reacciones de anhídridos y ésteres, así como la hidrólisis y transesterificación.




























![5. TRANSESTERIFICACIÓN EN MEDIO BÁSICO
Los ésteres transesterifican en presencia de alcóxidos,
según la reacción:
El etanoato de metilo [1] reacciona con etóxido de sodio
para formar etanoato de etilo [2] y metóxido de sodio [3].](https://image.slidesharecdn.com/funcionesorganicas-121015215752-phpapp02/85/Funciones-organicas-52-320.jpg)












![3. TRANSPOSICIÓN DE HOFMANN
Las amidas se transforman en aminas con un carbono menos, al
ser tratadas con bromo en disolución básica.
La acetamida [1] reacciona con bromo en medio básico
transformándose en metilamina [2] con pérdida de dióxido de
carbono.](https://image.slidesharecdn.com/funcionesorganicas-121015215752-phpapp02/85/Funciones-organicas-76-320.jpg)
![La transposición de Hofmann sólo tiene lugar con amidas
que tengan dos hidrógenos en el grupo amino (aminas no
sustituidas sobre el nitrógeno).
La amida, N-sustituida [4], forma una N-bromo
amida [5] por reacción con bromo en medio básico, pero no
da la transposición de Hofmann.](https://image.slidesharecdn.com/funcionesorganicas-121015215752-phpapp02/85/Funciones-organicas-77-320.jpg)