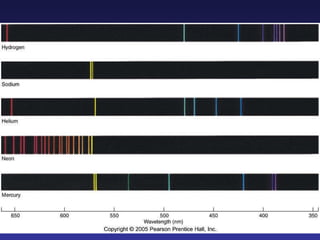
El documento presenta un resumen de la teoría cuántica y la estructura electrónica de los átomos. Explica cómo la teoría cuántica predijo la naturaleza cuántica de los electrones y su comportamiento ondulatorio, lo que llevó al desarrollo de modelos atómicos como los de Planck, Bohr, De Broglie y Schrödinger. También describe los cuatro números cuánticos que definen los estados electrónicos y cómo se organizan los electrones en las capas electrónicas de los á