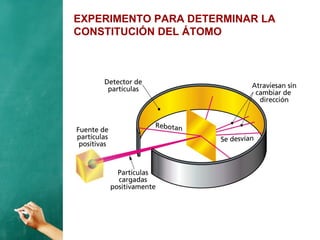
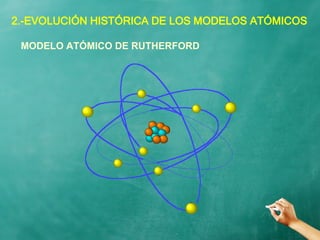
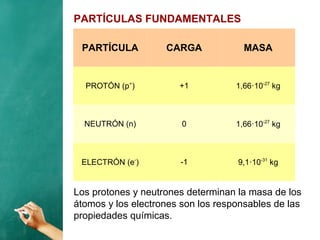
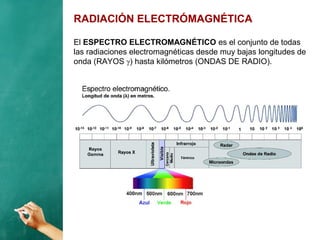
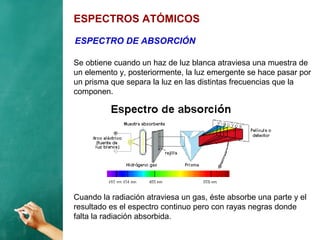
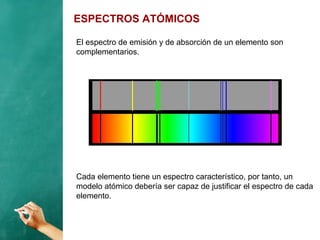
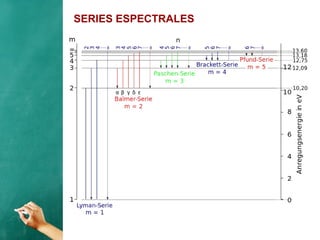
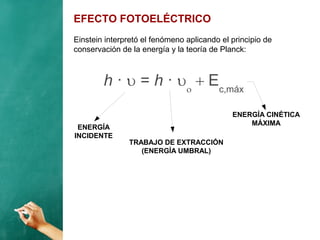
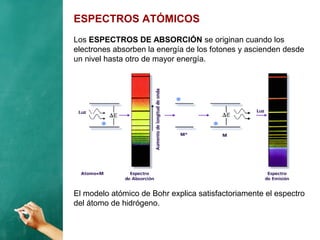
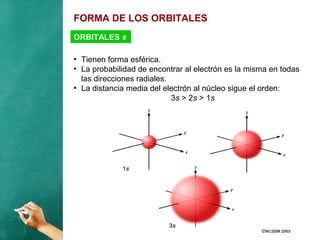
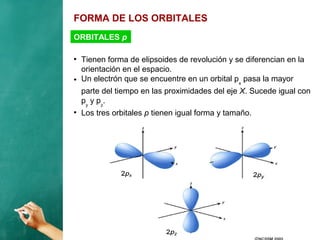
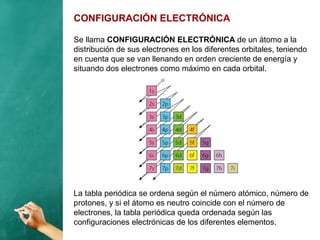
El documento describe la evolución histórica de los modelos atómicos, desde la teoría atómica de Dalton hasta el modelo de Bohr. Resume la teoría atómica de Dalton, el modelo de Thomson con el átomo como una esfera con carga positiva y electrones distribuidos en su interior, y el modelo de Rutherford con el núcleo central y los electrones en órbitas alrededor de este. También explica las contribuciones de Planck, Einstein, Thomson, Rutherford y Bohr para desarrollar la teoría cuántica a trav