clase08-reac quim
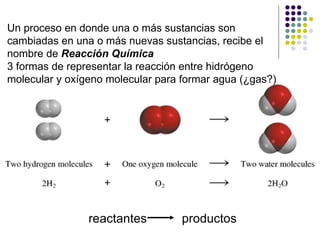
- 1. Un proceso en donde una o más sustancias son cambiadas en una o más nuevas sustancias, recibe el nombre de Reacción Química 3 formas de representar la reacción entre hidrógeno molecular y oxígeno molecular para formar agua (¿gas?) reactantes productos
- 2. ¿Cómo debo leer una reacción química? 2 Mg + O 2 2 MgO 2 átomos de Mg + 1 molécula de O 2 forman 2 moléculas de MgO 2 moles Mg + 1 mol O 2 forma 2 moles MgO 48,6 gramos Mg + 32,0 gramos O 2 forman 80,6 g MgO 2 grs Mg + 1 gr O 2 forma 2 grs MgO No confundir con
- 5. Ejemplo: Consideremos la combustión del butano (C 4 H 10 ) en el aire. Esta reacción consume oxígeno (O 2 ) y produce agua (H 2 O) y dióxido de carbono (CO 2 ). Podemos entonces escribir la ecuación química: Ahora contamos el número de átomos de cada elemento en reactivos y productos:
- 6. El carbono y el hidrógeno aparecen en un compuesto de los reactivos y en otro de los productos. Hay cuatro veces más de átomos de carbono en los reactivos que en los productos y cinco veces más hidrógeno en los reactivos que en los productos. Podemos arreglar esto cuadriplicando el número de moléculas de dióxido de carbono y quintuplicando el número de moléculas de agua:
- 7. Ahora que ya están balanceados los átomos de carbono e hidrógeno, falta ajustar los átomos de oxígeno. Ya que hay dos átomos en los reactivos y 13 en los productos bastaría con multiplicar por el coeficiente 13/2.
- 8. La preferencia es utilizar como coeficientes números enteros y no fraccionarios, así que tenemos que multiplicar la ecuación por 2: Ahora ya tenemos la ecuación balanceada y la podemos leer como: dos moléculas de butano reaccionan con trece de oxígeno produciendo diez moléculas de agua y ocho de dióxido de carbono.
- 9. ESTEQUIOMETRÍA La estequiometría es el estudio cuantitativo de reactivos y productos en una reacción química. La palabra estequiometría proviene de dos palabras griegas STOICHEIOM que significa elemento y HITREIN que significa medir. Literalmente, sería medir los elementos. Químicamente, la estequiometría es la parte de la química que se dedica a establecer las relaciones cuantitativas que existen entre los elementos que forman un compuesto, entre elementos y compuestos, cuando participan en una reacción.
- 10. Históricamente, la química no se empieza a desarrollar como ciencia sino hasta el año de 1789 con Lavoisier cuando enunció su famosa ley de la conservación de la masa “En las reacciones químicas la masa total de las substancias que en ellas intervienen permanece constante” (mientras no se trate de reacciones nucleares). Otras leyes como la de las proporciones definidas de Proust en 1806, la ley de las proporciones múltiples de Dalton en 1807, consolidan a la química como una ciencia exacta apoyada fuertemente por la estequiometría. En todas las industrias derivadas de la química se emplea la estequiometría, ya que sin ella no sería posible controlar los procesos para la obtención de productos, con ella se puede diseñar los procesos químicos adecuados para la producción y se puede evitar el desperdicio de recursos.
- 11. Al plantear las relaciones estequiométricas es necesario: PRIMERO: Escribir la ecuación química de la reacción planteada y balancearla. SEGUNDO: Determinar el número de moles de reactante y producto en los que se desea establecer la relación estequiométrica. TERCERO: Convertir los moles de las sustancias involucradas en gramos. CUARTO: Establecer la relación estequiométrica requerida a partir de los datos. Este método puede ampliarse para resolver cualquier tipo de relación estequiométrica.
- 12. Ejemplos: 1. En la reacción química: 3A + 2B 5C + 7D. Completar: a) .......... mol de A reaccionan con ........mol de B. b) ........... mol de B producen 5 moles de C. c) ........... mol de C producidos por 4 moles de B. d) La formación de 3,5 moles de D está acompañada por la formación de ............ moles de C. 2.– ¿Cuántos gramos de cloro deben de reaccionar con 10 gramos de sodio para producir NaCl? Primero: Escribir la ecuación balanceada 2 Na(s) + Cl 2 (g) 2NaCl(s)
- 13. Segundo: Establecer el número de moles reaccionantes. 2 Na + Cl 2 2 NaCl 2 moles + 1 mol 2 moles Tercero: Convertir los moles a gramos multiplicando el número de moles por la masa molar 2 moles de Na x 23 g/mol = 46 g de Na 1 mol de Cl 2 x 71 g/mol = 71 g de Cl 2 Cuarto: Establecer la relación estequiométrica 46 g de Na reaccionan con 71 g de Cl 2 como 10 g de Na reaccionarán con X g de Cl X = 15,4 g de Cl 2 deben reaccionar con 10 g de Na
- 14. 3. - Determinar la masa de cloruro de sodio necesaria para la obtención de 300 g de cloruro de hidrógeno (HCl) Primero: Escribir la ecuación balanceada 2 NaCl + H 2 SO 4 Na 2 SO 4 + 2HCl Segundo: Establecer el número de moles del NaCl y HCl 2NaCl + H 2 SO 4 Na 2 SO 4 + 2HCl 2 moles 1 mol 1 mol 2 moles Tercero: Convertir los moles de las substancias involucradas a gramos. 2 moles de NaCl x (23+35,5) = 117 g 2 moles de HCl x (1+35,5) = 73 g
- 15. Cuarto: Establecer la relación estequiométrica. 117 g de NaCl producen 73 g de HCl como X g de NaCl producirán 300 g de HCl Entonces: 480,2 g de NaCl se necesitan para obtener 300 g de HCl
- 16. Reactivos Limitantes Supongamos que estamos preparando el almuerzo para un grupo de escolares: un sandwich de jamón y queso. Para preparar un sándwich necesitaremos dos rebanadas de pan de molde, una rebanada de jamón y otra de queso. Hay 45 rebanadas de pan, 25 rebanadas de queso y 19 de jamón. Podremos preparar 19 sandwiches de jamón y queso y ninguno más porque no hay más jamón. Decimos entonces que el jamón es el ingrediente limitante del número de sandwiches preparados.
- 18. En una reacción química la situación es similar: una vez se haya consumido uno de los reactivos la reacción se detiene. 2 H 2 (g) + O 2 (g) 2 H 2 O (l) Así, si queremos obtener agua a partir de 10 moles de hidrógeno y 7 moles de oxígeno, como la estequiometría de la reacción es 2 moles de hidrógeno reaccionan con 1 mol de oxígeno para dar dos moles de agua, una vez que haya reaccionado todo el hidrógeno nos quedarán dos moles de O 2 y se habrán obtenido 10 moles de agua. Al reactivo que se ha consumido en su totalidad en una reacción química se le denomina “ reactivo limitante ” , ya que limita la cantidad de producto formado . Así en el ejemplo anterior el hidrógeno era el reactivo limitante, ya que con los 7 moles de oxígeno podríamos haber obtenido 14 moles de agua.
- 19. ¿Cómo operar para conocer cuál es el reactivo limitante de una reacción? Calculando los moles de producto que se obtienen con cada reactivo, suponiendo que el resto de reactivos están en cantidad suficiente. Aquel reactivo que nos dé el menor número potencial de moles de producto es el reactivo limitante. Al resto de reactivos, presentes en mayor cantidad que la necesaria para reaccionar con la cantidad del reactivo limitante, se les denomina reactivos en exceso .
- 20. Ejemplo: En un proceso, 124 g de Al reaccionan con 601 g de Fe 2 O 3 2Al + Fe 2 O 3 Al 2 O 3 + 2Fe Calcule la masa de Al 2 O 3 formada X = 7,8 moles de Al, por lo tanto, el reactivo limitante es el Al, porque tengo menos de lo necesario. n Al = 124g/27g/mol = 4,59 moles de Al n Fe 2 O 3 = 601g/154g/mol = 3,9 moles de Fe 2 O 3 2 moles de Al necesitan 1 mol de Fe 2 O 3 g Al mol Al mol Fe 2 O 3 nec. g Fe 2 O 3 nec. o g Fe 2 O 3 mol Fe 2 O 3 mol Al nec. g Al nec.
- 21. Usando el reactivo limitante (Al) se calcula la cantidad de producto formado X = 234 g Al 2 O 3 3.9 2 moles de Al forman 1 mol de Al 2 O 3 4,59 moles de Al forman X moles de Al 2 O 3 g Al mol Al mol Al 2 O 3 g Al 2 O 3 2Al + Fe 2 O 3 Al 2 O 3 + 2Fe