clase05-form empmol
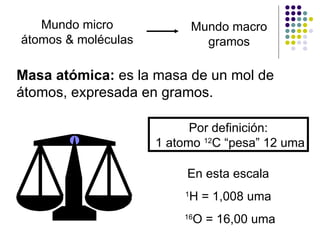
- 1. Por definición: 1 atomo 12 C “pesa” 12 uma En esta escala 1 H = 1,008 uma 16 O = 16,00 uma Masa atómica: es la masa de un mol de átomos, expresada en gramos. Mundo micro átomos & moléculas Mundo macro gramos
- 2. Litio natural está: 7.42% 6 Li (6.015 uma) 92.58% 7 Li (7.016 uma) = 6.941 uma Masa atómica promedio de litio: 7.42 x 6.015 + 92.58 x 7.016 100
- 3. Average atomic mass (6.941)
- 4. MOL: unidad química para representar cantidad de materia (átomos, moléculas, iones, electrones, etc.) = número de átomos que hay en exactamente 12 g de C 12 1 mol = N A = 6.0221367 x 10 23 Número de Avogadro ( N A ) Pair = 2 Dozen = 12
- 5. Masa molar es la masa de 1 mol de en gramos huevos zapatos átomos 1 mol 12 C atomos = 6,022 x 10 23 atomos = 12,00 g 1 mol de átomos de litio = 6,941 g de Li Para un elemento unidades de masa atómica (uma) = masa molar (gramos) ¿Cuántos átomos hay en 0,551 g de potasio (K) ? 1 mol de K = 39,10 g K 1 mol K = 6,022 x 10 23 atoms K 8,49 x 10 21 átomos de K
- 6. Masa molecular (o peso molecular) es la suma de las masas atómicas de los elementos (en g) en una molécula. 1 mol de moléculas SO 2 = 64,07 g ¿Cuál es la masa molar de NH 3 ? 1 N 14,010 g 3 H 3 x 1,008 g NH 3 17,034 g SO 2 1S 32,07 g 2O + 2 x 16,00 g SO 2 64,07 g
- 7. ¿Cuántas moléculas hay en un mol de NH 3 ? Como es un mol, hay 6,02 x 10 23 moléculas ¿Cuántos átomos de H hay en un mol de NH 3 ? Como hay 3 átomos de hidrógeno por cada molécula de NH 3 , hay 3 x 6,02 x 10 23 átomos de H . ¿Cuántos moles de NH 3 hay en 50 g de NH 3 ? 1 mol de NH 3 tiene una masa de 17,034 g x moles de NH 3 tiene una masa de 50 g x = 2,94 moles
- 8. ¿Cuántos átomos de hidrógeno hay en 72,5 g de C 3 H 8 O?
- 9. ¿Cuántos átomos de hidrógeno hay en 72,5 g de C 3 H 8 O? 1 mol C 3 H 8 O = (3 x 12) + (8 x 1) + 16 = 60 g C 3 H 8 O 1 mol H = 6,02 x 10 23 átomos de H = 58,21 x 10 23 átomos H 1 mol C 3 H 8 O de moléculas = 8 moles de átomos de H x mol C 3 H 8 O = 72,5 g C 3 H 8 O x = 1,2083 mol C 3 H 8 O
- 10. Ejercicios: 1.- Calcule la masa en gramos de: 3 moles de agua 1,8 X 10 22 moléculas de CO 2 2.- ¿Cuál es la masa de un mol de C 2 H 6 ? ¿cuántos moles de C e H hay? ¿cuántas moléculas de etano hay? y ¿cuántas de carbono e hidrógeno? 3.- Calcule los moles presentes en 170 g de: NaNO 3 CaCO 3 H 2 SO 4 K 2 HP0 4 Al 2 (SO 4 ) 3
- 11. Composición porcentual de un elemento en un compuesto n es el número de moles del elemento en 1 mol del compuesto 52,14% + 13,13% + 34,73% = 100,0% 3.5 n x molar mass of element molar mass of compound x 100% C 2 H 6 O %C = 2 x (12,01 g) 46.07 g x 100% = 52,14% %H = 6 x (1,008 g) 46.07 g x 100% = 13,13% %O = 1 x (16,00 g) 46,07 g x 100% = 34,73%
- 12. Fórmulas Empíricas y Moleculares Empírica indica sólo tipo y proporción de átomos en la molécula. Molecular indica tipo y número de átomos en la molécula. Por lo tanto, dos o más compuestos pueden tener igual fórmula empírica pero difieren en la molecular. Ejemplo: benceno (empírica: CH; molecular: C 6 H 6 ) acetileno (empírica: CH; molecular: C 2 H 2 ).
- 13. DETERMINACIÓN DE FÓRMULAS Estructural: análisis químico, reacciones características, métodos instrumentales, fuera del alcance de este curso. Empírica y molecular: Experimentalmente, se analizan los elementos que constituyen el compuesto y su composición (%). Con estos datos y, conociendo las masas atómicas de los elementos, se deduce la fórmula empírica según: 1. Cálculo de n de cada elemento presente (base de cálculo: 100 g de muestra). 2. Transformación de la relación de moles para que resulte una relación entre números enteros sencillos (dividiéndolas todas por la menor de ellas) 3. La anterior es la relación que existe entre los átomos que forman la molécula, es decir, la fórmula empírica .