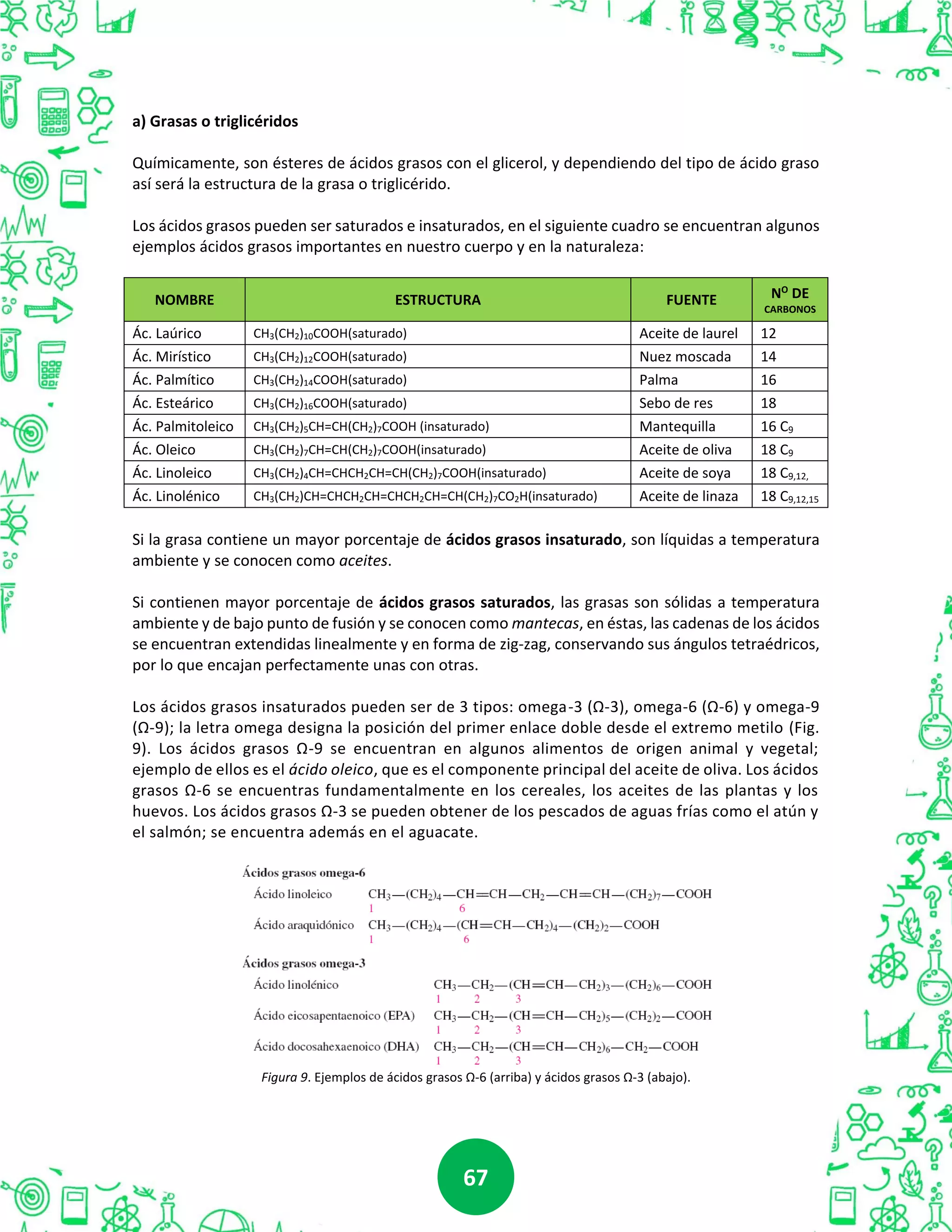
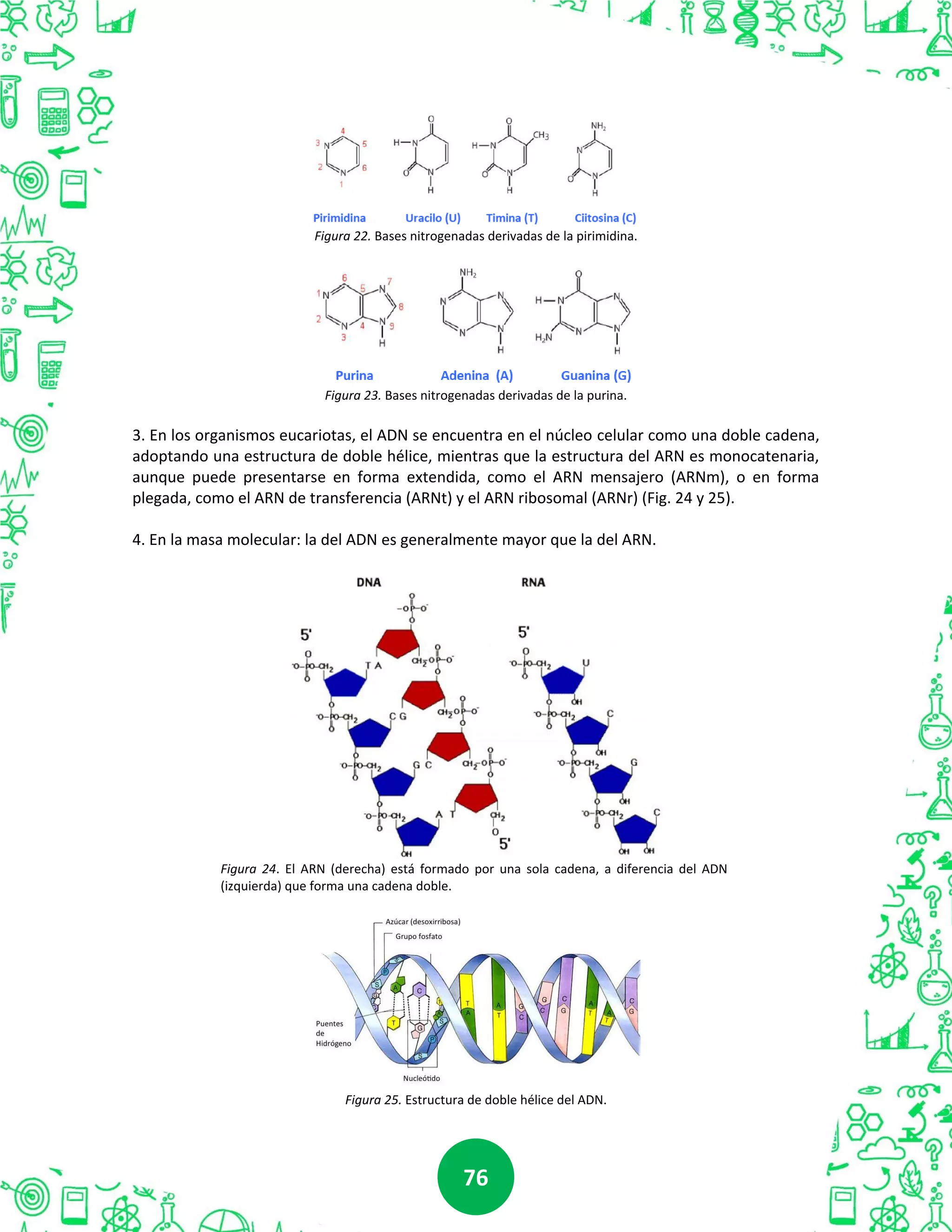
Este documento presenta información sobre compuestos orgánicos. En la Unidad I, se discuten los hidrocarburos, incluyendo el átomo de carbono, tipos de hibridación, y clases de hidrocarburos como alcanos, alquenos y aromáticos. La Unidad II cubre compuestos orgánicos oxigenados como alcoholes, fenoles, éteres, aldehídos y ácidos carboxílicos. La Unidad III trata aminas y amidas. Finalmente, la Unidad IV examina biomoléculas





















































![5555
d) Reducción de amidas. Las amidas se reducen con LiAlH4 para formar aminas. El número de
carbonos de la amina final es igual al de la amida de partida.
e) Síntesis de Gabriel. Esta síntesis permite obtener aminas primarias a partir de haloalcanos sin que
se formen mezclas de aminas secundarias y terciarias. La síntesis de Gabriel parte del ácido benceno-
1, 2 –dicarboxílico [1) que por reacción amoníaco crea ftalimida [2]. El tratamiento básico de la
ftalimida genera su sal [3], que se alquila por reacción con el haloalcano. Una hidrólisis final de la amida
deja libre la amina primaria y la sal del ácido benceno- 1, 2 –dicarboxílico.
1.6. Aplicaciones de las aminas
Las aminas se emplean, en general, en las industrias químicas, farmacéutica, caucho, plásticos,
tejidos, colorantes, cosméticos y metales. Se utilizan como productos químicos intermedios, como
disolventes, catalizadores, emulsionantes, inhibidores de corrosión, lubricantes sintéticos, agentes
de flotación y para la fabricación de pesticidas, herbicidas y colorantes. Concretamente:
La metilamina se emplea en la fabricación de productos agroquímicos, curtidos (agente
reblandecedor de piel y cuero), colorantes, fotografía (acelerador para reveladores),
farmacia y refuerzo de explosivos especiales.
La dimetilaminase usa en el proceso de vulcanización de caucho (como acelerador de
vulcanización), en la fabricación de curtidos, funguicidas, herbicidas, fibras artificiales,
disolventes y antioxidantes.
La trimetilamina se utiliza en la fabricación de bactericidas, cloruro de colina (asimilador de
grasas para animales) y se emplea también en la industria farmacéutica, en síntesis orgánica
y como detectar de las fugas de gases.
Las aminas son parte de los alcaloides que son compuestos complejos que se encuentran en las
plantas. Algunos de ellos son la morfina y la nicotina. Algunas aminas son biológicamente
importantes como la adrenalina y la noradrenalina. Las aminas secundarias que se encuentran en
las carnes y los pescados o en el humo del tabaco.](https://image.slidesharecdn.com/cndosierm4basicafinalizado-170419230826/75/DOSIER-CCNN-MODULO-IV-57-2048.jpg)