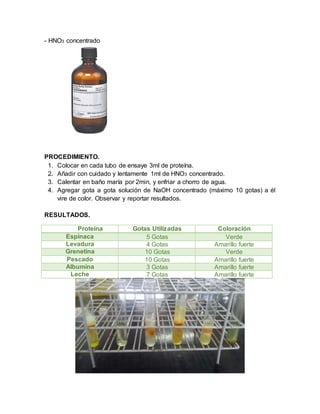
El documento detalla un experimento realizado para identificar proteínas mediante la reacción del reactivo Biuret y otros métodos. Se describen los objetivos, materiales, procedimientos y resultados de diferentes pruebas para detectar la presencia de proteínas en diversas muestras. Además, se concluye que las proteínas son esenciales en el organismo, cumpliendo múltiples funciones vitales, y se señala la importancia de la precisión en la experimentación debido al uso de sustancias químicas peligrosas.