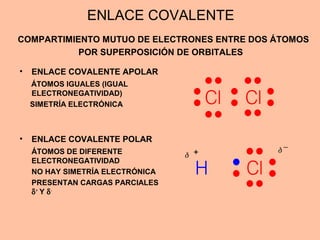
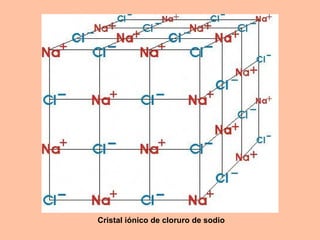
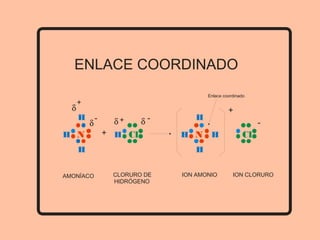
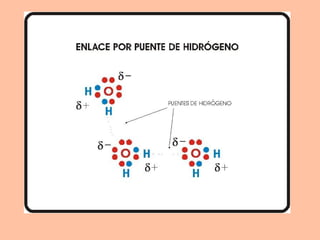
Este documento describe los diferentes tipos de enlaces químicos entre átomos, incluyendo enlaces iónicos, covalentes, metálicos y de hidrógeno. Explica que los átomos se unen para alcanzar una configuración estable de electrones y que los gases nobles no forman enlaces debido a que ya tienen una configuración estable. Además, detalla las propiedades distintivas de los compuestos formados por cada tipo de enlace.