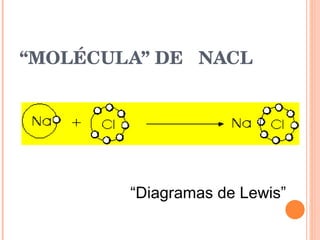
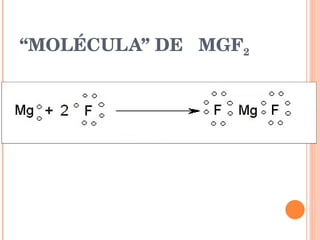
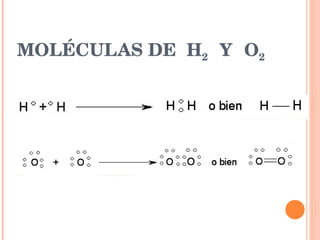
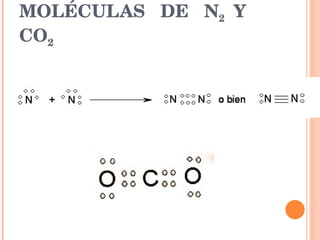
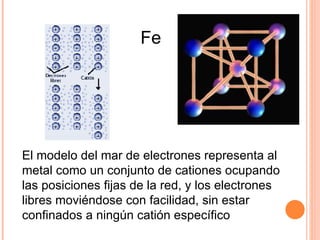
El documento describe los diferentes tipos de enlaces químicos entre átomos, incluyendo enlaces iónicos entre metales y no metales que forman iones, enlaces metálicos entre metales que comparten electrones en un mar de electrones, y enlaces covalentes entre no metales que comparten pares de electrones. También explica las propiedades características de los compuestos con cada tipo de enlace.