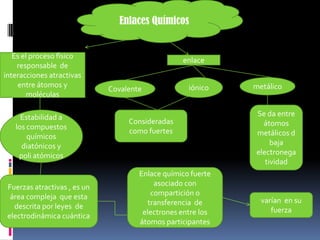
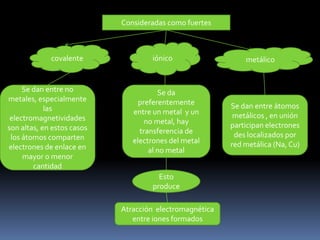
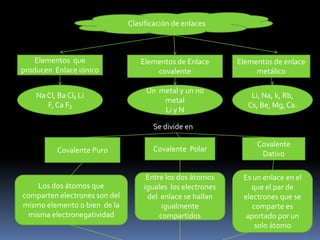
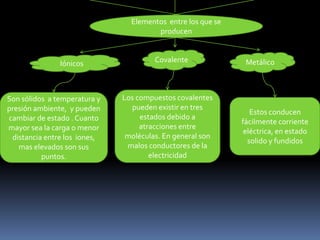
Este documento describe los diferentes tipos de enlaces químicos, incluyendo enlaces iónicos, covalentes y metálicos. Explica que los enlaces iónicos ocurren entre átomos con diferentes electronegatividades y provocan atracción electromagnética entre iones. Los enlaces covalentes ocurren cuando los átomos comparten o transfieren electrones y pueden ser puros, polares o dativos. Los enlaces metálicos ocurren entre átomos metálicos que comparten electrones deslocalizados en una red metálic