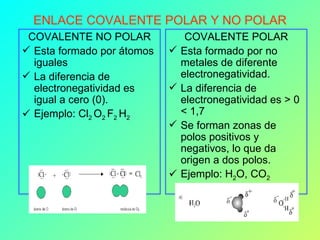
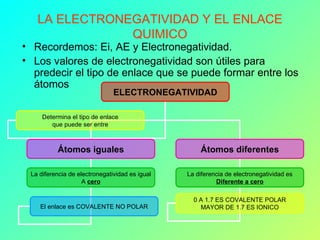
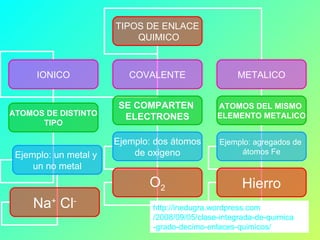
Este documento explica los diferentes tipos de enlaces químicos, incluyendo enlaces iónicos, covalentes, metálicos y coordinados. Los enlaces químicos son fuerzas que mantienen unidos los átomos y se forman cuando los átomos comparten, ceden o reciben electrones para alcanzar una configuración electrónica estable. El tipo de enlace depende de la electronegatividad de los átomos involucrados. Los enlaces iónicos ocurren entre metales y no metales, los covalentes entre no metal




![ENLACE IONICO CLORO Z =17: 1S 2 2S 2 2P 6 3S 2 3P 5 + 1e - = [Ne]3S 2 3P 6 Cl + 1e - = Cl - SODIO Z =11: 1S 2 2S 2 2P 6 3S 1 – 1e - = 1S 2 2S 2 2P 6 Na – 1e - = Na + Na + Cl - Fuerzas electrostáticas o fuerzas de atracción](https://image.slidesharecdn.com/presentacinenlacequimico-110803171821-phpapp01/85/Presentacion-enlace-quimico-7-320.jpg)