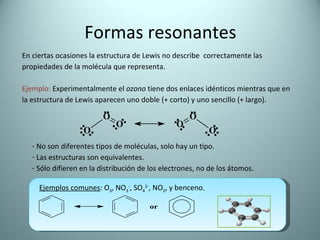
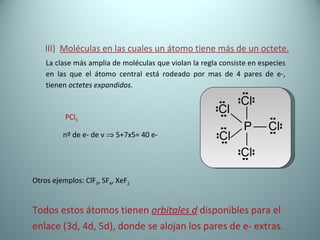
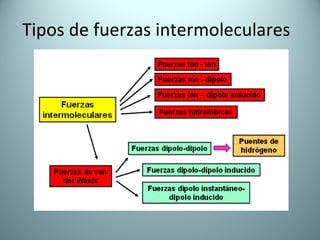
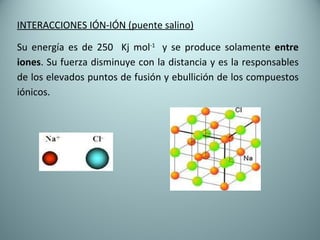
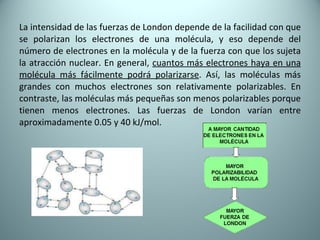
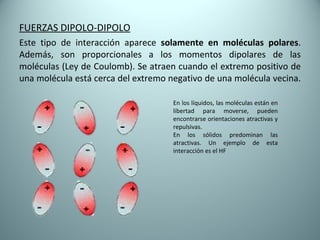
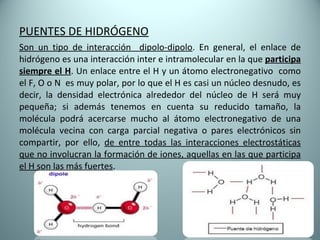
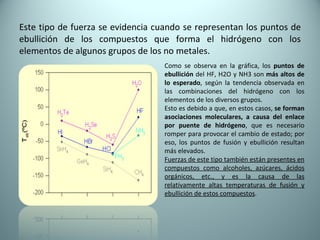
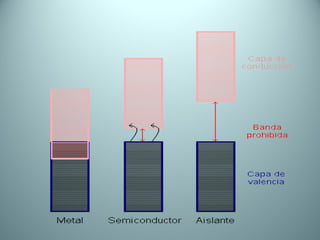
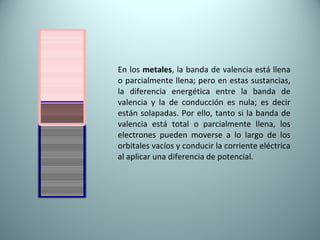
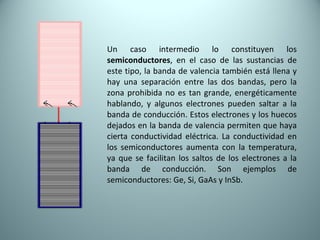
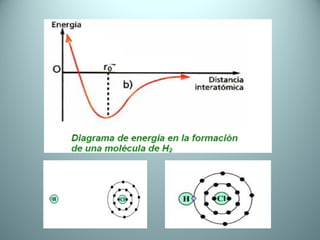
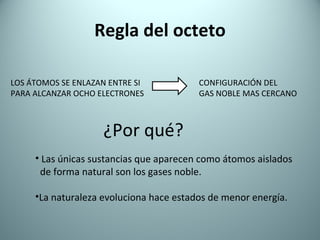
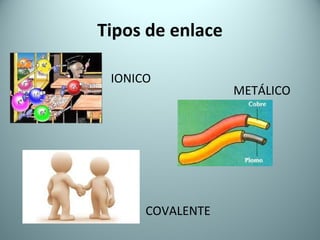
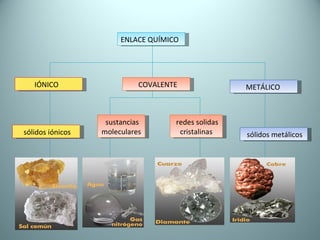
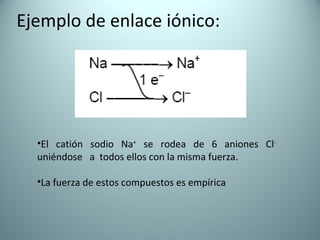
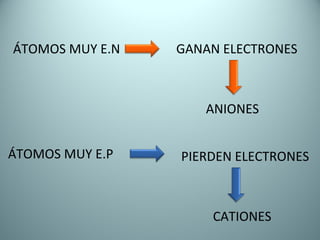
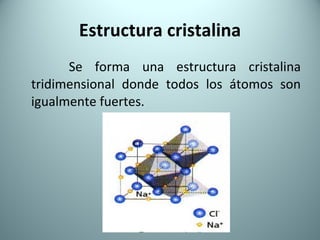
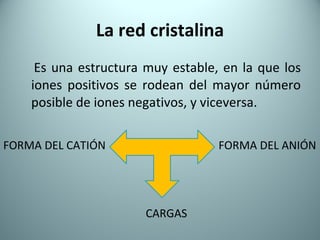
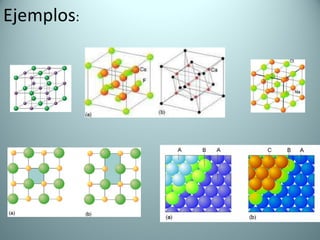
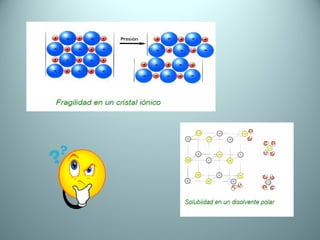
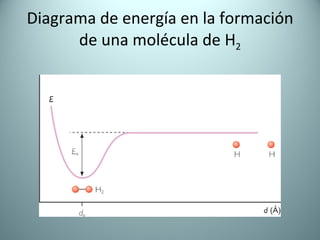
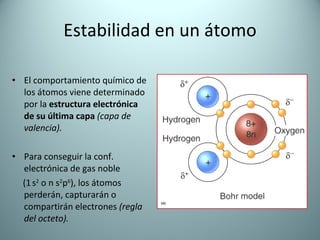
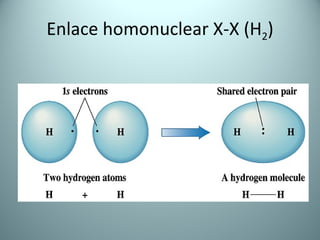
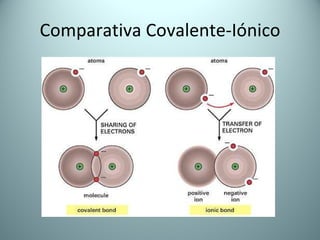
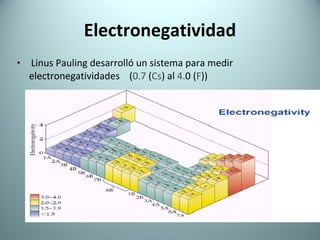
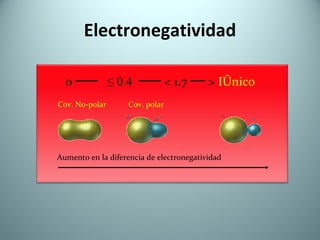
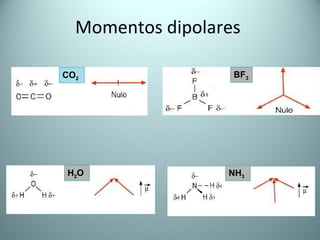
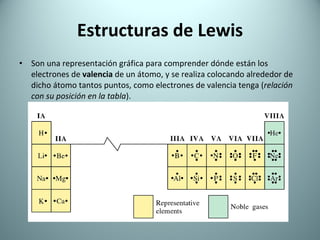
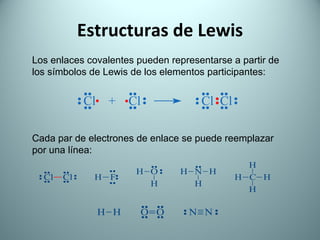
El documento proporciona una introducción al enlace químico, describiendo los tres tipos principales de enlace (iónico, covalente y metálico) y sus características. Explica que el enlace químico es el resultado de las interacciones eléctricas entre átomos y cómo esto da lugar a diferentes estructuras y propiedades en los compuestos. También presenta conceptos clave como la electronegatividad y las estructuras de Lewis para representar enlaces.






















![Estructura del CO 2 Paso 1 - Escribir la estructura fundamental mediante símbolos químicos. El átomo menos EN en el centro. H y F ocupan siempre posiciones terminales O C O Paso 2 - Calcular nº total de electrones de valencia C: [He]2s 2 2p 2 1 carbono x 4 electrones = 4 O: [He]2s 2 2p 4 2 oxígeno x 6 electrones = 12 número total de e- = 16 8 pares de e-](https://image.slidesharecdn.com/elenlacequimico-111123110400-phpapp02/85/El-enlace-quimico-43-320.jpg)

![Estructura del NH 3 Paso 1 Paso 2 N: [He]2s 2 2p 1 Nitrogeno x 5 e- H: 1s 1 3 Hidrógenos x 1 e- número total de e- = 8 e- 4 pares de e- Paso 3- Estructura de Lewis del NH 3 El N completa su octeto H tiene su capa completa con 2 electrones](https://image.slidesharecdn.com/elenlacequimico-111123110400-phpapp02/85/El-enlace-quimico-45-320.jpg)