1) El documento explica conceptos fundamentales relacionados con la masa atómica y las unidades utilizadas para medirla como la unidad de masa atómica unificada (uma).
2) También define conceptos como masa atómica, masa molecular, mol y cantidad de sustancia.
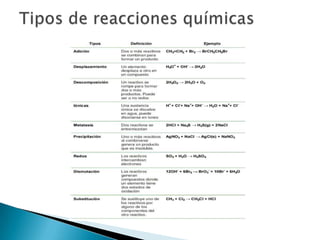
3) Finalmente, introduce conceptos clave de las reacciones redox como agentes oxidantes, agentes reductores y números de oxidación.