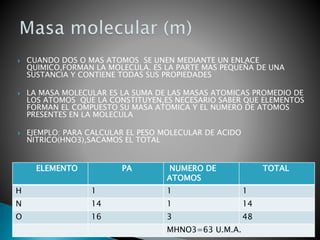
El documento resume conceptos clave sobre la estructura atómica y propiedades de los átomos y moléculas. Explica que los isótopos son átomos del mismo elemento que difieren en el número de neutrones, mientras que los isóbaros son núcleos con la misma masa pero diferente número atómico. También define el mol como la cantidad de sustancia que contiene la misma cantidad de entidades elementales que 12 gramos de carbono-12.