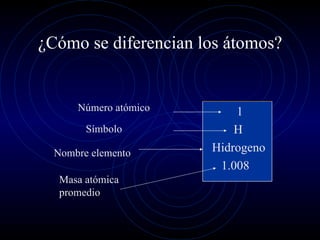
El documento resume la historia del desarrollo de la teoría atómica, desde las primeras especulaciones filosóficas sobre la naturaleza de la materia hasta el modelo atómico moderno. Destaca que Demócrito propuso la idea de que la materia estaba compuesta de átomos indivisibles, y que John Dalton desarrolló la teoría atómica moderna basada en los átomos como partículas idénticas que se combinan para formar compuestos. Finalmente, explica que el modelo atómico actual incluye electron