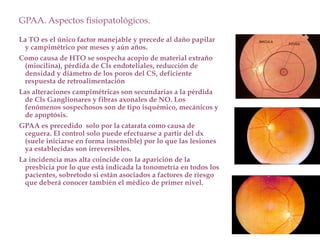
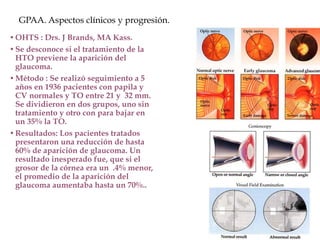
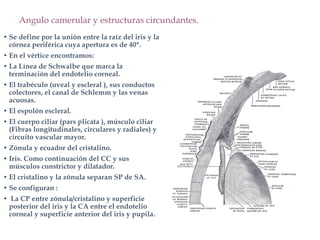
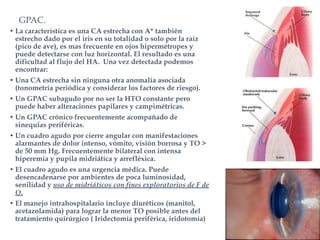
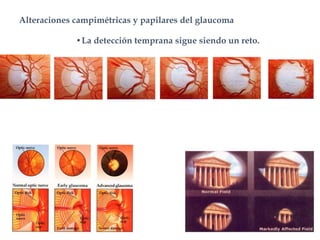
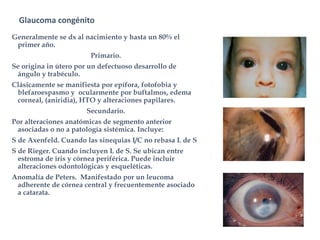
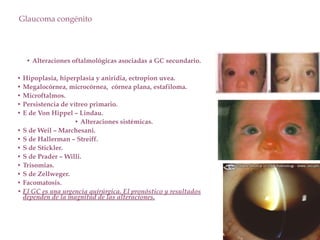
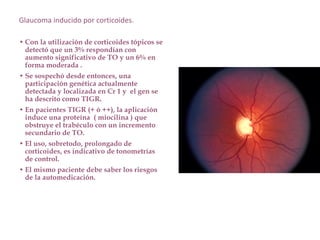
El documento aborda el glaucoma, centrándose en la tensión ocular (to) y su relación con la producción y drenaje del humor acuoso (ha). Se discuten los factores de riesgo como la edad, la raza y la miopía, así como diferentes métodos de tonometría y sus implicaciones en el diagnóstico y tratamiento de diversas formas de glaucoma, incluyendo la congénita y la inducida por corticoides. Además, se exploran aspectos genéticos asociados al glaucoma y su incapacidad para ser revertido una vez establecido.