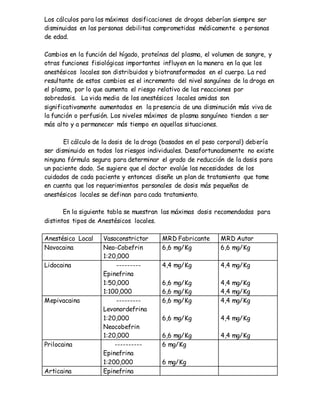
La ansiedad es una respuesta emocional normal que ayuda a la supervivencia ante amenazas. Sin embargo, en algunos casos se vuelve patológica y causa trastornos de ansiedad. Estos trastornos se caracterizan por síntomas fisiológicos, cognitivos y de conducta que ocurren con frecuencia y causan gran sufrimiento. Aunque la ansiedad patológica es de por vida, muchos pacientes pueden lograr una recuperación parcial o completa con terapia cognitivo-conductual a largo plazo.