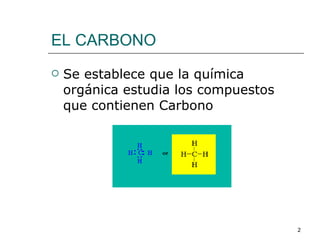
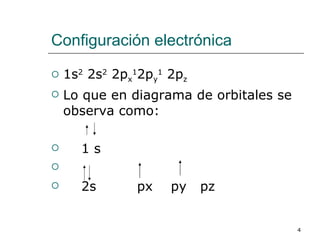
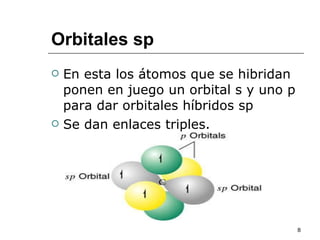
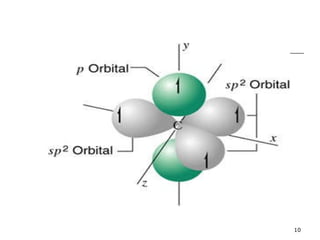
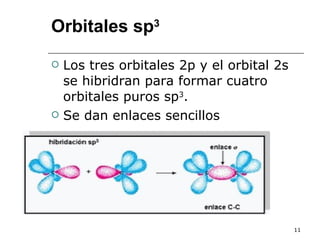
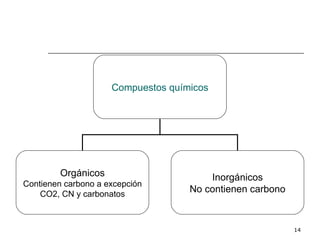
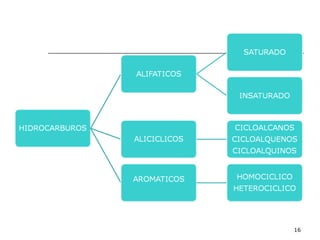
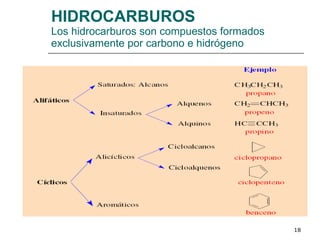
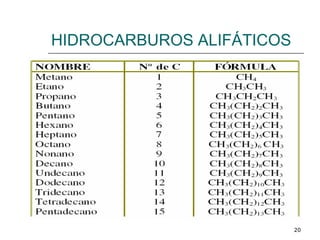
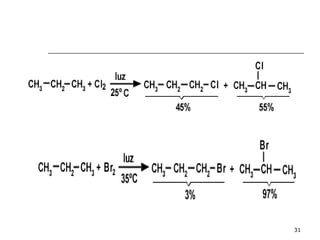
El documento habla sobre los hidrocarburos y el carbono. Explica que el carbono puede encontrarse en diferentes formas alotrópicas como grafito, diamante y fullereno. También describe la tetravalencia del carbono y los diferentes tipos de hibridación como sp, sp2 y sp3 que permiten la formación de enlaces. Además, define los compuestos orgánicos e inorgánicos y menciona que los hidrocarburos son compuestos formados por carbono e hidrógeno.