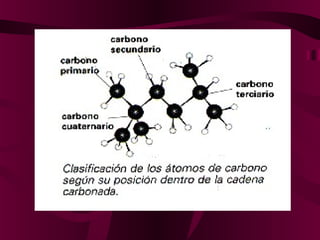
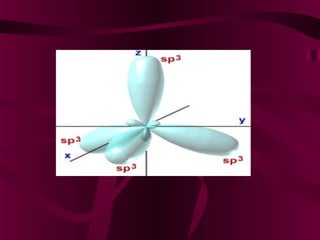
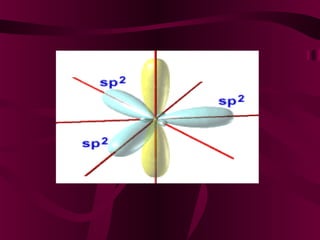
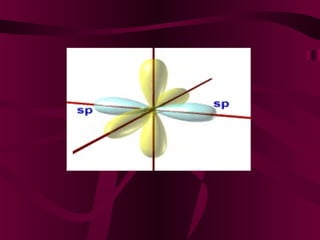
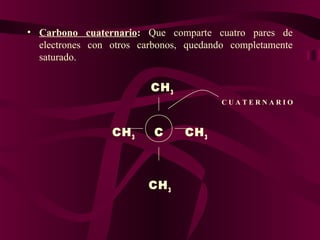
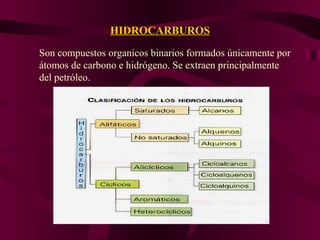
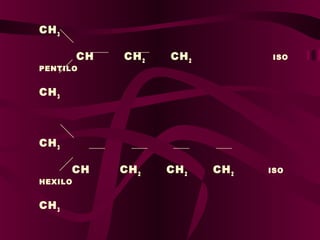
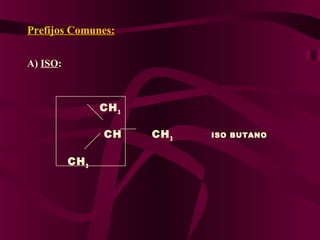
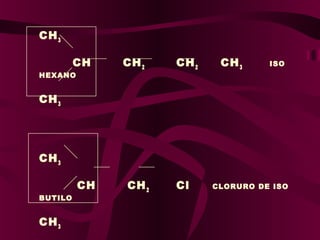
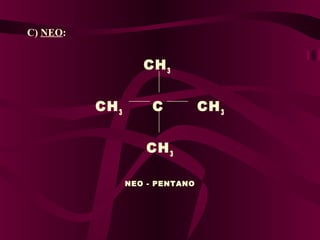
El documento describe los conceptos clave de la química orgánica, incluyendo la hibridación del carbono, los tipos de átomos de carbono, las fórmulas químicas y la nomenclatura de los hidrocarburos como los alcanos. Explica que los alcanos son compuestos orgánicos formados solo por carbono e hidrógeno unidos por enlaces simples, y que su fórmula general es CnH2n+2.