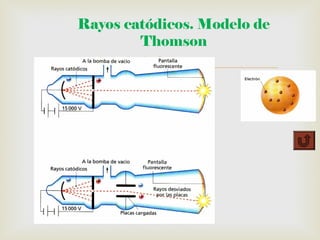
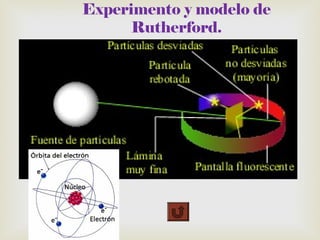
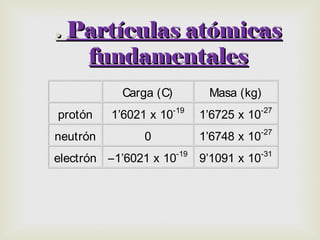
El documento resume los principales descubrimientos relacionados con las partículas subatómicas y la radiación electromagnética. Se describe el descubrimiento del electrón a través de los rayos catódicos, del protón en los rayos anódicos, y más tarde del neutrón. También se mencionan los rayos X, la radiactividad y las diferentes partículas emitidas, y la naturaleza electromagnética de la radiación.