Este documento presenta una revisión de la hiperpotasemia. Explica la homeostasis del potasio y los mecanismos renales y extrarrenales que regulan los niveles de potasio, incluidos los efectos de la aldosterona, la insulina y las catecolaminas. También analiza las posibles etiologías de la hiperpotasemia y la importancia del reconocimiento y tratamiento oportunos debido al riesgo de arritmias fatales.

![Hiperpotasemia: una revisión
Kimberley J. Evans, MD
Arthur Greenberg, MD
El potasio es el principal catión intracelular y el mantenimiento
de la distribución de potasio entre los compartimentos
intracelular y extracelular depende de varios mecanismos
homeostáticos. Cuando estos mecanismos se alteran, puede
ocurrir hipopotasemia o hiperpotasemia. Esta revisión cubre la
hiperpotasemia, es decir, una concentración de potasio sérico
superior a 5 mmol / L. La revisión incluye un análisis de la
homeostasis del potasio y las etiologías de la hiperpotasemia y
se centra en el reconocimiento y tratamiento oportunos de la
hiperpotasemia. Este trastorno debe ser motivo de gran
preocupación para los médicos debido a su propensión a
causar arritmias fatales. La hiperpotasemia se diagnostica
fácilmente y se dispone de tratamientos rápidos y eficaces.
Desafortunadamente, el tratamiento de esta afección
potencialmente mortal a menudo se retrasa o no se presta la
suficiente atención o es agresivo.
relación de concentración de potasio extracelular,
cambios mínimos en la concentración extracelular más
pequeña pueden resultar en grandes cambios en las
propiedades eléctricas de las células [5]. Por tanto, el
mantenimiento de este gradiente de potasio es
esencial y depende de varios procesos: la carga de
potasio en la dieta, la distribución de potasio entre el
compartimento intracelular y extracelular y la
excreción renal de potasio [6]. La hiperpotasemia se
define como una elevación del potasio sérico a un valor
superior a 5 mmol / L.
Mantenimiento de la homeostasis del potasio
Palabras clave: homeostasis del potasio, hiperpotasemia, etiologías de la
hiperpotasemia, tratamiento de la hiperpotasemia En una dieta occidental, se estima que la ingesta diaria
de potasio oscila entre 50 y 100 mmol, el 90% del cual
se excreta en la orina y el resto en las heces. La
excreción renal es lenta. Solo el 50% de la carga de
potasio se puede eliminar en un período de 4 a 6
horas. Por lo tanto, el mantenimiento a corto plazo de
la concentración de potasio extracelular depende de
mecanismos extrarrenales que pueden responder en
cuestión de minutos.
Los factores que afectan la excreción renal de potasio
incluyen la liberación distal de sodio, el sistema renina-
angiotensinaldosterona, vasopresina, la ingesta dietética
de potasio, el estado ácido-base, el flujo urinario y la
concentración sérica de potasio. La manipulación
extrarrenal del potasio está influenciada por los niveles
basales de insulina y catecolaminas, la hormona tiroidea,
la hormona paratiroidea y el estado ácido-base [7].
Desde la descripción original del potasio por Sir
Humphrey Davy [1] y James Woodhouse en 1807
[2], se han descrito la distribución del potasio dentro
del cuerpo y los mecanismos de la homeostasis del
potasio y sus perturbaciones. El potasio corporal total
es de aproximadamente 50 mmol / kg, el 98% del cual
es intracelular [3,4]. En la mayoría de las circunstancias,
los valores de potasio plasmático y sérico están dentro
del 10% entre sí y pueden considerarse idénticos. La
distribución del potasio corporal total entre los
espacios intracelular y extracelular da como resultado
un gran gradiente de concentración de potasio entre
estos dos compartimentos. La concentración de
potasio intracelular es de aproximadamente 150
mmol / L y la concentración extracelular de
aproximadamente 4 mmol / L. Debido a que el
potencial de reposo de la membrana depende de la
Mantenimiento renal de la homeostasis
del potasio
Del Centro Médico de la Universidad de Duke, Departamento de Medicina, División
de Nefrología, Durham, Carolina del Norte.
Nota del autor
Recibido el 4 de enero de 2005 y en forma revisada el 6 de mayo de 2005. Aceptado
La secreción de potasio hacia el lumen de la nefrona
distal es pasiva. Este movimiento pasivo de potasio
depende del gradiente de concentración a través de
la membrana luminal, el gradiente eléctrico
negativo de la luz (generado principalmente por la
reabsorción de sodio) que favorece la secreción y la
permeabilidad de la membrana luminal al potasio.
para su publicación el 19 de mayo de 2005.
Envíe la correspondencia a Kimberley J. Evans, MD, Centro Médico de la
Universidad de Duke, Departamento de Medicina, División de
Nefrología, Box 3014, Durham, NC 27710, o envíe un correo electrónico
a: evans122@mc.duke.edu.
Evans KJ, Greenberg A. Hyperkalemia: una revisión. J Med de cuidados
intensivos. 2005; 20: 272-290.
DOII :: 10.1177 / 0885066605278969
272 Copyright © 2005 Publicaciones Sage
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-2-320.jpg)
![Hiperpotasemia
Aldosterona
gradiente electroquímico para la secreción de potasio
en la luz tubular y es responsable del efecto de estos
fármacos para limitar la excreción de potasio. Se ha
demostrado que la vasopresina aumenta la secreción
urinaria de potasio mediante el aumento del número
de canales de potasio luminales abiertos [15].
La aldosterona juega su papel principal en la regulación de la
homeostasis del potasio a través de mecanismos renales. La
aldosterona aumenta la secreción renal de potasio a través de
su acción sobre las células del segmento de conexión, las
células principales del túbulo colector cortical y medular y el
conducto colector. A nivel celular, la aldosterona abre los
canales de Na apicales y aumenta el Na+-K+ Actividad de la
ATPasa en las membranas basolaterales, lo que resulta en un
aumento de la secreción de potasio [8,9]. La aldosterona
media su efecto después de unirse a los receptores en el
núcleo celular. Los antagonistas de la aldosterona
espironolactona y eplerenona inhiben competitivamente esta
unión. Los principales estímulos para la secreción de
aldosterona son la angiotensina II y las elevaciones de los
niveles séricos de potasio.
[10]. Los aumentos del potasio sérico tan pequeños como 0,1
mmol / L estimulan la síntesis de aldosterona en la zona
glomerulosa de la glándula suprarrenal. La aldosterona
también influye en la regulación extrarrenal de la secreción de
potasio a través del aumento de la secreción colónica y salival
de potasio [11]. Normalmente, el intestino es responsable de
solo el 5% de la excreción total de potasio; sin embargo, en
individuos con enfermedad renal, esto puede aumentar
sustancialmente hasta representar del 30% al 50% de la
excreción de potasio [12]. La aldosterona también puede
desempeñar un papel en el desplazamiento transcelular de
potasio hacia el compartimento transcelular [13].
Mantenimiento extrarrenal
de la homeostasis del potasio
Insulina. Los niveles fisiológicos de insulina son importantes
en la regulación de la homeostasis del potasio en el estado
basal, así como en las condiciones de carga de potasio. El
papel de la insulina en el mantenimiento de la homeostasis del
potasio es a través de la estimulación directa de la captación
de potasio intracelular por el Na+-K+-ATPasa en hígado,
músculo esquelético y células grasas. En el contexto de una
deficiencia de insulina (es decir, diabetes), hay una
disminución de la captación de potasio por los músculos y el
hígado [13,16]. El efecto reductor de potasio de la insulina es
independiente de la estimulación adrenérgica. Además, sus
efectos hipopotasémicos dependen de la dosis.
Catecolaminas. Las catecolaminas, específicamente los
agonistas adrenérgicos β2, estimulan la captación
intracelular de potasio mediante la estimulación de Na+- K+
-ATPasa en sujetos humanos normales [6,17,18]. La
administración de epinefrina, albuterol o salbutamol
disminuye los niveles séricos de potasio [19-22]. El
propranolol, un bloqueador β no selectivo, bloquea este
efecto, pero el atenolol, un bloqueador β selectivo, no lo
hace. Además, el isoproterenol, un agonista β-
adrenérgico, no tiene ningún efecto sobre los niveles
séricos de potasio [23,24]. Los agonistas α-adrenérgicos
como la fenilefrina aumentan el potasio sérico al alterar la
captación intracelular de potasio, un efecto bloqueado por
la administración concomitante del antagonista α-
adrenérgico fentolamina [25]. La fenilefrina no afecta la
excreción urinaria de potasio, los niveles de insulina,
renina o aldosterona. En circunstancias normales, el
aumento de la producción de catecolaminas asociado con
la alimentación y el ejercicio vigoroso atenúa el aumento
de la concentración sérica de potasio que, de otro modo,
podría resultar de la absorción de potasio del intestino o la
liberación de las células musculares [26]. Los agonistas β-
adrenérgicos también son una opción terapéutica en
individuos con hiperpotasemia.
Concentración de potasio en plasma
La concentración de potasio en plasma afecta directamente la
excreción de potasio en orina, un efecto independiente de su
capacidad para aumentar los niveles de aldosterona. El
aumento de la secreción urinaria de potasio está mediado por
la estimulación de Na+- K+ ATPasa y apertura de Na luminal+ y K
+ canales en los túbulos distales [14].
1
Otros factores
La excreción urinaria de potasio también está influenciada por
la liberación distal de sodio y el flujo de orina. En entornos
donde hay un aumento en el suministro de sodio distal y el
flujo de orina, hay un aumento en la secreción de potasio. Las
condiciones que disminuyen el suministro de sodio
disminuyen la excreción urinaria de potasio, al igual que las
disminuciones en el flujo de orina atribuibles a la depleción de
volumen o al deterioro de la función renal. La reabsorción de
sodio a través del canal de sodio epitelial en el conducto
colector está bloqueada por amilorida y triamtereno. La
reducción de la entrada de sodio disminuye la
2
Estado ácido-base. En general, se ha creído que por
cada 0,1 descenso del pH, hay un aumento de 0,6
mmol / L en la concentración sérica de potasio en el
contexto de acidosis aguda [27]. En la alcalosis
metabólica aguda, se ha observado la relación opuesta
Revista de Medicina de Cuidados Intensivos 20 (5); 2005 273
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-3-320.jpg)
![Evans y Greenberg
observado, donde hay un aumento en la captación de
potasio intracelular a cambio de iones de hidrógeno
que resulta en una disminución en la concentración de
potasio. Un examen minucioso de los estudios que
informaron originalmente estos cambios, así como los
estudios posteriores, demuestra una variabilidad
considerable en el aumento del potasio sérico que
varía de 0,3 mmol / L a 1,3 mmol / L por cada 0,1 U de
disminución del pH [27-29]. Además, la relación entre
el pH y el potasio sérico no se muestra de manera
confiable para todas las etiologías de acidosis. Por
ejemplo, la acidosis respiratoria aumenta el potasio
sérico mucho menos que un grado comparable de
acidosis metabólica y la acidosis orgánica no tiene un
efecto constante. Sólo en el contexto de la acidosis
metabólica causada por ácidos minerales se produce
un desplazamiento constante del potasio del
compartimento intracelular al extracelular [30,31]. La
relación entre el potasio y los trastornos acidobásicos
crónicos es muy variable y, a menudo, impredecible.
En cualquier nivel de función renal, es más probable que
ocurra hiperpotasemia en personas que tienen afecciones
médicas concurrentes (p. ej., deficiencia de insulina) o que
usan medicamentos (p. ej., inhibidores de la enzima
convertidora de angiotensina [IECA]) que los predisponen a
alteraciones de la homeostasis del potasio.
Etiologías de la hiperpotasemia
La capacidad del cuerpo humano para adaptarse
eficientemente a grandes cargas de potasio normalmente
evita que el potasio sérico se eleve por encima de lo
normal. Por tanto, el desarrollo de hiperpotasemia
requiere la presencia concomitante de un defecto en uno
o más de los mecanismos que mantienen la homeostasis
del potasio. Los factores que pueden afectar estos
mecanismos homeostáticos y dar lugar a hiperpotasemia
pueden agruparse en tres categorías: (1) aumento de la
carga de potasio, (2) disminución de la excreción renal de
potasio y (3) cambios de potasio transcelulares.
Se desconoce la incidencia de hiperpotasemia en la
población general. En los pacientes hospitalizados, la
incidencia varía del 1,3% al 10% y depende de cómo se
defina la hiperpotasemia [37-40]. La función renal alterada
es el principal factor de riesgo para el desarrollo de
hiperpotasemia y está presente en el 33% al 83% de todos
los casos [37,38,41]. Los medicamentos solos o junto con
otros factores representan del 35% al 75% de los casos
[37,38,41] (tabla 1). La tasa de mortalidad informada
asociada con la hiperpotasemia varía ampliamente y no
tiene en cuenta ninguna contribución de la
hiperpotasemia indocumentada a las muertes
ambulatorias por arritmias.
Adaptación de potasio
Tanto la manipulación extrarrenal como renal del
potasio protege contra la hiperpotasemia. La eficacia
de estos mecanismos aumenta con el aumento de las
cargas de potasio. El proceso de adaptación al potasio
comienza después de una sola comida rica en potasio,
y aumenta con la ingesta adicional de potasio. Esta
adaptación se produce en gran parte debido a un
aumento en la excreción urinaria de potasio. Además,
la tasa de captación intracelular de potasio es más
rápida [17]. También hay un aumento en la secreción
colónica de potasio. El proceso de adaptación del
potasio se ve facilitado por el aumento de la secreción
de aldosterona asociado con el aumento de la
concentración sérica de potasio [32]. Aunque se
produce cierto grado de adaptación del potasio
después de la adrenalectomía, una respuesta completa
depende de la aldosterona.
La adaptación al potasio es un mecanismo
importante para mantener la normopotasemia en
personas con insuficiencia renal siempre que la ingesta
de potasio no sea excesiva [33]. En estos individuos hay
un aumento tanto en el número como en la actividad
del Na+-K+-Canales ATPasa en el riñón funcional
restante, lo que da como resultado un aumento en la
excreción fraccionada de potasio.
[13]. Además, hay un marcado aumento de la secreción
colónica de potasio, acompañado de un aumento de Na
+-K+-Actividad ATPasa en la mucosa colónica [34]. En
individuos con enfermedad renal, la hiperpotasemia
puede ocurrir en una amplia gama de grados de
deterioro de la función renal [35,36]. A
Pseudohiperpotasemia
La pseudohiperpotasemia es una elevación artificial del
potasio sérico in vitro. Dado que el potasio plasmático es
normal, no existe ningún defecto en la homeostasis del
potasio. La importancia de la pseudohiperpotasemia
radica únicamente en la necesidad de reconocerla para
poder ignorarla; el tratamiento específico es inapropiado.
La pseudohiperpotasemia está presente cuando la
concentración sérica de potasio excede la concentración
plasmática de potasio en más de 0.5 mmol / L. Ocurre
cuando las plaquetas, los glóbulos blancos o los glóbulos
rojos se lisan in vitro, liberando su contenido rico en
potasio en el suero. La pseudohiperpotasemia se describió
originalmente en asociación con trombocitosis, definida
como un recuento de plaquetas superior a 750 000 mm–3
[42]. Estudios posteriores han demostrado su presencia
con leucocitosis (blanco
274 Revista de Medicina de Cuidados Intensivos 20 (5); 2005
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-4-320.jpg)
![Hiperpotasemia
Tabla 1. Causas de la hiperpotasemia Tabla 1 (continuación)
Aumento de la carga de potasio
Exógeno
Alimentos con alto contenido de
potasio Cloruro de potasio
Sustitutos de la sal
Penicilina G de potasio
Soluciones Collins
Sangre almacenada
Suplementos proteicos
calóricos Geofagia
Medicamentos a base de hierbas
jugo de noni
Alfalfa
Diente de león
Cola de caballo
Ortiga
Algodoncillo
Bayas de Hawthorne
Endógeno
Hemólisis
Ejercicio
Hemorragia gastrointestinal
Estados catabólicos
Rabdomiólisis
Lisis tumoral aguda
Hiperplasia suprarrenal congénita
Hiporreninismo primario
Hipoaldosteronismo hiporreninémico (ATR tipo IV)
Insuficiencia suprarrenal
Primaria (enfermedad de Addison) Destrucción
infecciosa de la glándula suprarrenal
Mycobacterium Avium Intracellulari
VIH
CMV
Tuberculosis micobacteriana
Bloquear los canales de sodio en las células principales.
Triamtereno
Amilorida
Trimetoprima
Pentamidina
Otro
Síndrome de Gordon
Disminución del suministro distal de sodio
Cirrosis por insuficiencia cardíaca congestiva
avanzada
Nefropatía por pérdida de sal
Insuficiencia renal
Desplazamiento transcelular
Hiperglucemia
Bloqueadores beta no
selectivos Succinilcolina
Hemólisis aguda
Digoxina (inhibición de Na + -K + -ATPasa)
Ejercicio vigoroso
Envenenamiento por fluoruro
Manitol
Somastatina
Parálisis periódica hiperpotasémica
Aminoácidos intravenosos
Arginina
Lisina
Ácido épsilon-aminocaproico
Medicamentos a base de plantas
(inhibición de Na + -K + -ATPasa)
Piel de sapo
Chan su
Adelfa
Dedalera
Baya de tejo
Lirio de los valles
Dogbane
ginseng siberiano
Squill rojo
Acidosis metabólica aguda causada por ácidos
minerales (no ocurre con la acidosis orgánica)
Disminución de la excreción renal de potasio.
Enfermedad renal crónica
Insuficiencia renal aguda
Deterioro de la secreción tubular renal distal
Defecto secretorio tubular renal primario
Lupus eritematoso sistémico
Enfermedad de células falciformes
Uropatía obstructiva
Amiloidosis postrasplante
de riñón
Nefritis tubulointersticial
Necrosis papilar
Alteraciones del sistema renina-angiotensina-
aldosterona
Drogas
Inhibidor de la ECA
Bloqueador del receptor de angiotensina
Agentes antiinflamatorios no esteroideos
Inhibidores de la calcineurina (tacrolimus,
ciclosporina)
Heparina
Litio
Antagonista de la aldosterona
(espironolactona, eplerenona)
Hipoaldosteronismo primario ECA: enzima convertidora de angiotensina; RTA - acidosis tubular
renal; CMV: citomegalovirus.
(continuado)
células sanguíneas mayores de 50000 mm–3), esferocitosis
hereditaria, hemólisis de la muestra, separación retardada
del suero de los glóbulos rojos, punción venosa
inapropiada, uso de anticoagulantes inapropiados como
ácido etilendiaminotetraacético en los tubos de
recolección y apretar los puños durante la flebotomía
[43]. No se ha demostrado que el uso de un torniquete
solo provoque seudohiperpotasemia [44].
Mayor carga de potasio
La entrada de potasio en el compartimento
extracelular puede provenir de fuentes tanto exógenas
como endógenas. Los alimentos particularmente ricos
en potasio (más de 6,4 mmol por porción) incluyen
plátanos (18,5 mmol cada uno), jugo de naranja (~ 13
mmol por 8 onzas líquidas) y otras frutas cítricas y
Revista de Medicina de Cuidados Intensivos 20 (5); 2005 275
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-5-320.jpg)
![Evans y Greenberg
jugos, tomates (1 tomate mediano contiene 6.41 mmol de
potasio) y jugo de tomate (14.5 mmol por 8 onzas
líquidas), melón, melón dulce, melocotones, papas (1 papa
al horno contiene 15.6 mmol), sustitutos de la sal (0-13
mmol de potasio por gramo) y sal Morton Lite (5 mmol por
“batido”) [45,46]. Los medicamentos a base de hierbas a
menudo se pasan por alto como fuente de potasio
exógeno. Un ejemplo es el jugo de Noni (Morindia
citrifolia, 14 mmol por 8 onzas líquidas). Otros
medicamentos a base de hierbas con alto contenido de
potasio se enumeran en la Tabla 1 [47].
Los fármacos también pueden presentar cargas
importantes de potasio. Los ejemplos incluyen penicilina,
suplementos de proteínas y calorías, sangre almacenada,
solución de Collins y, por supuesto, el propio cloruro de
potasio [48]. Generalmente, la concentración de potasio de
la sangre almacenada aumenta en 1 mmol / L / d. Este
aumento depende de la cantidad de tiempo que se
almacena la sangre y del conservante utilizado. La solución
conservante de Collin, que contiene 141 mmol / L de
potasio, ha provocado hiperpotasemia después del
trasplante de riñón de cadáver [49].
En general, el potasio obtenido de fuentes exógenas es
manejado hábilmente por el cuerpo humano a lo largo del
tiempo. Sin embargo, si el mecanismo homeostático se ve
afectado por una función renal reducida, falta de insulina
u otras causas (ver arriba) o si se administran grandes
cantidades de potasio en un período corto de tiempo,
estos sistemas pueden verse abrumados. Por ejemplo, el
cloruro de potasio cuando se administra como una dosis
única de 0,5 mmol / kg generalmente no da como
resultado un aumento significativo de la concentración de
potasio en suero. Sin embargo, cuando se administra en el
contexto de un deterioro concomitante de la función renal,
una dosis tan pequeña como de 35 a 45 mmol puede
provocar hiperpotasemia [50].
La liberación endógena de potasio ocurre cuando hay
un aumento en la degradación celular de los tejidos (Tabla
1). Además, durante el ejercicio hay una liberación de
potasio del músculo esquelético intacto, mediada por la
depleción de trifosfato de adenosina (ATP) y la apertura
resultante de los canales de potasio del músculo
esquelético dependientes de ATP. La liberación de potasio
es proporcional al grado de ejercicio, y varía desde un
aumento del potasio sérico de 0,3 mmol / L a 0,4 mmol / L
con ejercicio leve a 2 mmol / L con ejercicio intenso [51].
Normalmente, este cambio transitorio en la concentración
sérica de potasio es asintomático, regresa a los niveles
previos al ejercicio dentro de los 5 minutos posteriores al
cese del ejercicio y se atenúa con el entrenamiento. En
personas con enfermedad arterial coronaria subyacente,
puede producirse una elevación del potasio sérico a
niveles más bajos de ejercicio [52].
La rabdomiólisis y el síndrome de lisis tumoral aguda
pueden producir hiperpotasemia atribuible a la liberación de
potasio de células lisadas. El síndrome de lisis
tumoral aguda es una constelación de anomalías
metabólicas que se desarrollan en individuos
después del tratamiento de ciertas neoplasias
malignas, aunque puede ocurrir espontáneamente
con tumores con recambio muy rápido. Este
síndrome se observa con mayor frecuencia en
personas con linfoma de Burkett o leucemia aguda,
pero no se limita a estos trastornos. La
hiperpotasemia que se desarrolla en este síndrome
es multifactorial y se desarrolla como resultado de
la rápida lisis de una gran carga de células, el
desplazamiento transcelular atribuible a la acidosis
metabólica aguda y la disminución de la excreción
renal si se desarrolla insuficiencia renal por
hiperuricemia. La hiperpotasemia grave también se
produce con rabdomiólisis aguda [53,54]. La salida
de potasio del compartimento intracelular al
compartimento extracelular, que puede ser
inducida por fármacos o traumatismos.
Disminución de la excreción renal de potasio
Debido a que el riñón es el principal responsable de la
excreción de potasio, la función renal reducida por cualquier
causa se asocia con un mayor riesgo de hiperpotasemia en
proporción a la disminución de la tasa de filtración glomerular.
Además, algunos trastornos alteran la excreción de potasio en
un grado desproporcionado a la disminución general de la
función renal.
Deterioro de la secreción tubular distal
de potasio
La interferencia con la secreción de potasio del túbulo distal
renal se puede atribuir a factores que alteran directamente la
estructura del túbulo distal y a los que alteran su función. Las
enfermedades renales estructurales asociadas con
hiperpotasemia desproporcionadas al grado de disfunción
renal incluyen el lupus eritematoso sistémico (LES) [55], la
anemia de células falciformes
[56], uropatía obstructiva [57], trasplante de riñón y
amiloidosis [43]. Además, cualquier condición que
resulte en fibrosis tubulointersticial o atrofia tubular
también causará alteraciones en la secreción de
potasio tubular renal. Estos trastornos pueden estar
presentes a pesar de la preservación de la tasa de
filtración glomerular (TFG) [58].
Los diuréticos ahorradores de potasio como la espironolactona,
eplerenona, triamtereno y amilorida son una causa común de
hiperpotasemia. Generalmente causan hiperpotasemia dentro de
los primeros 10 días de uso con una incidencia
276 Revista de Medicina de Cuidados Intensivos 20 (5); 2005
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-6-320.jpg)
![Hiperpotasemia
dencia del 4% al 19% [41,58]. Cuando estos medicamentos se
utilizan en personas con alteraciones adicionales de la homeostasis
del potasio, puede producirse una hiperpotasemia potencialmente
mortal [59]. Por ejemplo, en pacientes que recibieron IECA
concomitantes y diuréticos ahorradores de potasio, los niveles
séricos de potasio tan altos como
Se han notificado 9,4 mmol / L a 11 mmol / L [60]. Este
efecto hiperpotasémico de la espironolactona también
se ha demostrado en personas con enfermedad renal
en etapa terminal (ESRD), lo que no es sorprendente
dados los efectos conocidos de la aldosterona sobre el
manejo celular y gastrointestinal del potasio. El efecto
máximo de la espironolactona oral se puede demostrar
de 48 a 73 horas después de la ingestión y continúa
durante el mismo período de tiempo después de la
interrupción. Las dosis de espironolactona de 100 a
300 mg / día producen hiperpotasemia grave en
personas con cirrosis [61]. La trimetoprima, un
inhibidor de la dihidrofolato reductasa, altera la
secreción tubular renal de potasio al bloquear los
canales de sodio epiteliales, con una mayor eficacia a
un pH urinario bajo [62]. El efecto antikaliurético de la
trimetoprima puede minimizarse aumentando el pH de
la orina y aumentando el flujo de orina con
medicamentos como la furosemida [63]. La asociación
de trimetoprima con hiperpotasemia reversible se
describió por primera vez en pacientes con VIH
tratados porPneumocystis cariniineumonía (PCP) con
dosis altas (20 mg / kg) administradas por vía
intravenosa [62]. Estudios posteriores han demostrado
que se produce una hiperpotasemia significativa en
individuos tratados con dosis convencionales de menos
de 360 mg / d, ya sea que se administren por vía
parenteral u oral. Se ha informado que la incidencia de
hiperpotasemia es del 21,2% en pacientes
hospitalizados tratados con trimetoprim-
sulfametoxazol [64]. Estos individuos tuvieron un
aumento de 1,21 mmol / L en los niveles de potasio
sérico, alcanzando un máximo a los 4,6 días. El riesgo
de hiperpotasemia aumentó en individuos con
creatinina sérica superior a 1,2 mg / dl [65]. El efecto
hiperpotasémico de la trimetoprima se potencia con la
administración concomitante de dapsona, porque esta
última inhibe el metabolismo hepático de la
trimetoprima [62]. Pentamidina, otro agente utilizado
para el tratamiento de la PCP,
El hipoaldosteronismo hiporreninémico (HRHA) es un
trastorno caracterizado por niveles reducidos de renina y
aldosterona. El hipoaldosteronismo suele ser multifactorial
[67]. La depleción crónica de volumen con furosemida puede
restaurar en parte la secreción de aldosterona, lo que sugiere
que la deficiencia de renina es la causante. Sin embargo, la
hiperpotasemia debe estimular la secreción de aldosterona
independientemente de la secreción de renina y las dosis de
fludrocortisona en exceso de la estándar
Se requieren dosis de reemplazo para corregir el
defecto excretor de potasio. Por tanto, el defecto
puede ser intraadrenal o posreceptor. En los adultos, la
causa más común es la diabetes mellitus, pero el LES,
la uropatía obstructiva y la nefropatía falciforme
también pueden ser responsables [43,67].
Varios agentes farmacológicos pueden inducir
HRHA. Los fármacos antiinflamatorios no esteroideos
(AINE) causan hipoaldosteronismo hiporreninémico al
alterar la producción de prostaglandina E2 y
prostaglandina I2 [68]. Además de estimular la síntesis
de renina, estas prostaglandinas estimulan la apertura
de canales de potasio de alta conductancia, que
ayudan a facilitar la secreción de potasio en el túbulo
distal [41]. Además, los AINE causan vasoconstricción,
lo que altera el suministro de agua y sal al túbulo
distal. El efecto hiperpotasémico de estos agentes se
describió inicialmente con indometacina. Sin embargo,
es un efecto de clase que ocurre tanto con los
inhibidores selectivos de la ciclooxigenasa (COX) -2
como con los inhibidores no selectivos de la COX-1 /
COX-2. Se ha informado que la incidencia de
hiperpotasemia con esta clase de fármacos es tan alta
como 46%, con un aumento de los niveles séricos de
potasio en 0,2 mmol / L en personas con función renal
normal y superior a 1 mmol / L en personas con
insuficiencia renal o una alteración adicional de la
homeostasis del potasio [68,69]. generalmente ocurre
dentro de los 3 a 7 días de uso. Los AINE también
pueden causar hiperpotasemia cuando producen
insuficiencia renal aguda.
Los IECA disminuyen la liberación de aldosterona
mediada por renina y pueden disminuir la TFG, lo que
altera aún más la secreción de potasio. Los individuos más
susceptibles a los efectos adversos de estos agentes son
aquellos que tienen alteraciones subyacentes de la función
renal, estenosis de la arteria renal o depleción de volumen
real o efectiva. El diez por ciento de las personas que
reciben IECA en el ámbito ambulatorio, así como entre el
9% y el 36% de los pacientes hospitalizados desarrollarán
hiperpotasemia. Con un aumento gradual en el riesgo de
hiperpotasemia inversamente proporcional al nivel de
función renal, el aumento del potasio sérico puede ocurrir
dentro de la semana de tratamiento. La incidencia de
hiperpotasemia en individuos con función renal normal
oscila entre el 0 y el 11% [70]. En personas con
insuficiencia renal, la incidencia aumenta del 5 al 50%
[71,72]. Por lo menos
El 7,8% de los ingresos hospitalarios por hiperpotasemia en
pacientes de edad avanzada se produjeron como
consecuencia del uso concomitante de IECA con diuréticos
ahorradores de potasio [73].
Los bloqueadores de los receptores de angiotensina (BRA) se unen a
los receptores de angiotensina-II, disminuyendo el efecto de la
angiotensina-II y, por lo tanto, dando lugar a una disminución de la
Revista de Medicina de Cuidados Intensivos 20 (5); 2005 277
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-7-320.jpg)
![Evans y Greenberg
aldosterona. La reducción de los niveles de aldosterona
sérica y urinaria ha sido similar a la lograda por los
IECA. Las incidencias de hiperpotasemia también son
similares, un 1,3% con IECA y un 1,5% con ARA II en
individuos sanos [74]. La incidencia de hiperpotasemia
aumenta al 7% en los ancianos a los que se les
administran ARA [75]. Los niveles séricos de potasio
aumentaron una media de 0,3 mmol / L con el uso de
ARB [76]. El uso de IECA y ARA II se asocia con un
aumento del riesgo de hiperpotasemia entre los
pacientes en diálisis con función renal residual y los
anúricos [77].
El tacrolimus y la ciclosporina [78,79] causan
hiperpotasemia a través de la inhibición del eje renina-
angiotensina, disminuyendo el Na+-K+-Actividad ATPasa e
inhibiendo directamente los canales de potasio de los
túbulos colectores. Se ha informado que la incidencia de
hiperpotasemia oscila entre el 27 y el 67% [79]; sin
embargo, este aumento de la incidencia también puede
atribuirse al desarrollo de insuficiencia renal en individuos
tratados crónicamente con estos medicamentos. Se ha
informado que la incidencia en individuos sin evidencia de
nefrotoxicidad es del 9%. La hiperpotasemia inducida por
heparina [80] es secundaria a la interferencia con la
síntesis de aldosterona a través de la inhibición de la
conversión de corticosterona en 18-hidroxicorticosterona
dentro de la glándula suprarrenal. Además, hay una
reducción en el número y la afinidad de los receptores de
angiotensina-II en las células de la zona glomerulosa
suprarrenal. La hiperpotasemia ocurre en el 8% al 17% de
los pacientes que reciben heparina
[81]. La inhibición de la secreción de potasio ocurre
dentro de 1 a 3 días de uso y es máxima a los 3 a 5
días. Los efectos comienzan a disminuir con la
interrupción del medicamento y desaparecen en 1 a 3
días. También se ha observado hiperpotasemia con
preparaciones de bajo peso molecular, así como con
heparinoides, independientemente de la dosis o vía de
administración [82,83].
La hiperpotasemia es una característica de la deficiencia de
aldosterona resultante de la insuficiencia suprarrenal. Las
etiologías incluyen destrucción suprarrenal autoinmune,
hemorragia suprarrenal, metástasis suprarrenales e infección
suprarrenal, incluida la tuberculosis y el citomegalovirus
relacionado con el VIH oMycobacterium avium complejo.
En este contexto, el sodio en orina es inferior a 10 mmol /
L. El potasio en orina puede estar por debajo de 40 mmol / L si
el suministro de sodio es lo suficientemente bajo. Incluso si es
mayor, la excreción diaria total de potasio sigue siendo baja
debido al bajo volumen de orina. Generalmente, la
hiperpotasemia que se desarrolla en la insuficiencia cardíaca
congestiva y la cirrosis es leve. Sin embargo, las personas con
estas afecciones a menudo tienenCo factores de riesgo
existentes para el desarrollo de hiperpotasemia, como
diabetes o edad avanzada, y a menudo se tratan con agentes
que pueden alterar la secreción de potasio, como
espironolactona, IECA o ARA II.
Cambio transcelular
Aunque la acidosis metabólica se ha implicado
repetidamente como factor causante del desarrollo de
hiperpotasemia a través del desplazamiento transcelular
de potasio desde el compartimento intracelular al
extracelular, este paradigma ha sido desafiado (ver más
arriba). La hiperglucemia que se produce
espontáneamente como una característica de la diabetes
mellitus mal controlada o después de la administración de
glucosa sin insulina se asocia con un aumento de los
niveles séricos de potasio. El aumento medio de los niveles
séricos de potasio ha oscilado entre 0,1 y 2,0 mmol / L [84].
Este aumento no requiere la presencia concomitante de
hipoaldosteronismo [85]. Los informes de casos han
ilustrado una relación temporal entre el aumento de las
concentraciones séricas de glucosa y el desarrollo de
hiperpotasemia. Aunque no se documentó el mecanismo
exacto en casos individuales, los posibles mecanismos
incluyen el desplazamiento transcelular atribuible a la
hiperosmolalidad con arrastre de solutos, la captación
celular alterada de potasio atribuible a la deficiencia de
insulina o la presencia de hipoaldosteronismo
hiporreninémico [86]. En virtud de su capacidad para
suprimir la secreción de insulina, la somatostatina también
puede provocar hiperpotasemia [87].
La administración intravenosa de aminoácidos como
arginina, lisina y ácido ε-aminocaproico desplaza el
potasio del espacio intracelular al espacio extracelular
[59,88]. Este cambio transcelular es independiente del
pH y es directamente proporcional a la concentración
sérica del aminoácido. En personas con función renal
normal, la arginina intravenosa aumentó el potasio
sérico entre 0,6 mmol / L y 1 mmol / L. El aumento de la
concentración de potasio extracelular se compensa con
un aumento concomitante de la excreción renal de
potasio. Se han demostrado elevaciones del potasio
sérico que oscilan entre 0,6 mmol / L y 1,5 mmol / L en
Disminución de la administración distal de sodio
y el flujo de orina
La hiperpotasemia puede desarrollarse en condiciones que
disminuyen el flujo de orina y el suministro distal de sodio,
típicamente los estados que forman edema como insuficiencia
cardíaca congestiva, cirrosis y síndrome nefrótico.
278 Revista de Medicina de Cuidados Intensivos 20 (5); 2005
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-8-320.jpg)
![Hiperpotasemia
individuos con y sin insuficiencia renal después de la
administración de aminoácidos [89].
La succinilcolina y otros agentes paralizantes
despolarizantes desplazan el potasio fuera de las células. El
efecto hiperpotasémico de la succinilcolina se puede observar
inmediatamente con un aumento del potasio de 1 a 1,7
mmol / L. Característicamente se resuelve en 10 minutos.
[90]. En individuos que tienen lesiones musculares
concomitantes, quemaduras, infecciones graves y
crónicas, paraplejía, hemiplejía, rotura de aneurismas
cerebrales, tétanos, traumatismos craneales cerrados [91],
encefalitis o un trastorno neuromuscular, hay un aumento
incremental mayor en el nivel de potasio sérico. Se han
demostrado aumentos de hasta 3 mmol / L [92]. En las
personas con lesiones o quemaduras musculares, se
desarrolla una mayor sensibilidad al medicamento entre 4
y 5 días después de la lesión y, a menudo, se prolonga y
dura desde varios meses hasta un año [59]. Los digitálicos
a niveles tóxicos pueden provocar hiperpotasemia. En
los individuos que desarrollan hiperpotasemia en el
contexto de una intoxicación por digitálicos, existe un
mayor riesgo de mortalidad si el potasio sérico es superior
a 5,5 mmol / L [93]. En general, los niveles terapéuticos de
digital no producen hiperpotasemia a menos que haya
una perturbación adicional en la homeostasis del potasio.
Por ejemplo, se ha descrito hiperpotasemia en informes
de casos de personas con insuficiencia renal que también
estaban tomando bloqueadores adrenérgicos β [94].
El manitol, como la glucosa, es osmóticamente activo y
puede causar hiperpotasemia por desplazamiento transcelular
con arrastre de solutos [95]. El potasio sérico aumenta de 0,4 a
0,8 mmol / L por cada aumento de 10 mOsm / kg en la
osmolalidad plasmática efectiva. El ejercicio intenso se asocia
con un aumento del potasio sérico de 3 a 4 mmol / L en los
primeros minutos de ejercicio.
[96]. Durante la despolarización y la contracción
muscular, el potasio se escapa de la célula y se
recupera durante la repolarización a través de Na+-K+
-ATPase. Esta hiperpotasemia inducida por el ejercicio
aumenta con el uso concomitante de digitalis [97].
Los bloqueadores β-adrenérgicos pueden causar
hiperpotasemia en el contexto de una carga de potasio,
ejercicio intenso, hipoaldosteronismo o insuficiencia renal.
[98]. Además de su efecto directo para impedir la captación celular
de potasio, el bloqueo de la liberación de renina estimulada por
catecolaminas da como resultado una disminución de la síntesis de
aldosterona [99]. El uso de labetalol, antagonista de los receptores
adrenérgicos α, β combinados para tratar la hipertensión
posoperatoria en receptores de trasplante de riñón e individuos
que reciben hemodiálisis, ha causado hiperpotasemia de potasio
[100, 101]. El metoprolol y el propranolol interfieren con la
restauración de la normopotasemia después del ejercicio en
individuos normales. Concentraciones tan altas como 7.8 mmol / L
tienen
se ha encontrado en individuos normales que tomaron
propranolol de forma crónica [51]. Este efecto también se ha
producido con agentes tópicos como las gotas oftálmicas de
timolol [102].
La parálisis periódica hiperpotasémica [103] es un trastorno
autosómico dominante en el que un defecto en el canal de sodio
del músculo esquelético da como resultado un desplazamiento
transcelular de potasio hacia el compartimento extracelular. Los
ataques ocurren durante el descanso, después del ejercicio o
después de ingerir una comida baja en carbohidratos. La
hiperpotasemia puede estar presente en sólo el 50% de los
individuos con parálisis periódica hiperpotasémica.
Pacientes con riesgo de hiperpotasemia
A partir de la discusión anterior, debe quedar claro que
muchos pacientes tienen más de un factor de riesgo para
el desarrollo de hiperpotasemia. Los pacientes con
insuficiencia cardíaca y función renal disminuida o
disminución del suministro distal de sodio también es
probable que reciban fármacos que impiden la secreción
de potasio. La función renal alterada contribuye al
desarrollo de hiperpotasemia provocada por fármacos,
rabdomiólisis u otros factores.
Cabe destacar que las personas de edad
avanzada tienen un riesgo especial de desarrollar
hiperpotasemia. Pueden tener numerosos factores
de riesgo que predisponen al desarrollo de
hiperpotasemia, como función renal reducida,
diabetes mellitus y uso de medicamentos que
interfieren con la homeostasis del potasio [59,104].
En las personas que requieran medicamentos que
puedan predisponerlos a la hiperpotasemia, se deben
tomar medidas preventivas. Por ejemplo, se puede alentar
a las personas que utilizan IECA o ARA II para la
cardioprotección o como medida renoprotectora a que
sigan una dieta baja en potasio. Se pueden prescribir
bloqueadores beta selectivos como metoprolol o atenolol
en lugar de bloqueadores beta no selectivos como
carvedilol, y deben evitarse los AINE. El uso concomitante
de diuréticos de asa kaliuréticos también puede ser útil
para prevenir esta complicación.
1
Efectos adversos de la hiperpotasemia
La toxicidad de la hiperpotasemia es el resultado de su efecto
para despolarizar las membranas celulares eléctricamente
activas, incluidos el músculo cardíaco y esquelético. Las
manifestaciones cardíacas de la hiperpotasemia incluyen
ondas T pico, prolongación del intervalo PR y ensanchamiento
del QRS seguido de pérdida de actividad auricular, fibrilación
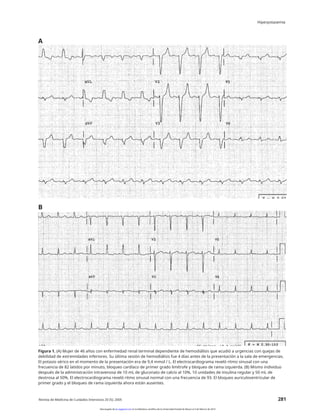
ventricular y asistolia [105] (figura 1). los
Revista de Medicina de Cuidados Intensivos 20 (5); 2005 279
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-9-320.jpg)
![Evans y Greenberg
Los cambios electrocardiográficos (ECG) de la
hiperpotasemia son proporcionales al potasio sérico sólo
en un sentido general [105-107] y pueden observarse en el
46% al 64% de los pacientes con niveles de potasio sérico
superiores a 6,0 mmol / L [37,109]. Sin embargo, la
fibrilación ventricular o la asistolia pueden ser la
manifestación ECG inicial de una hiperpotasemia grave, y
los niveles de potasio superiores a 9 mmol / L no siempre
provocan cambios en el ECG [3,37,108]. Las
manifestaciones neuromusculares de la hiperpotasemia
incluyen diarrea, dolor abdominal, mialgias y parálisis
flácida de las extremidades [110]. Los factores que pueden
potenciar el efecto deletéreo de la hiperpotasemia
incluyen su velocidad de desarrollo, así como la presencia
de otros trastornos metabólicos como acidosis metabólica,
hipocalcemia o hiponatremia.
El efecto potencialmente mortal de la hiperpotasemia sobre
el músculo cardíaco es de gran preocupación. La tasa de
mortalidad por hiperpotasemia en pacientes hospitalizados
oscila entre el 1,7% y el 41% [38,40]. A pesar de la tasa de
mortalidad conocida asociada con la hiperpotasemia, el
tratamiento con frecuencia no se proporciona o es
inadecuado. En un estudio de 406 pacientes con
hiperpotasemia definida como potasio sérico superior a 6,0
mmol / L, aproximadamente el 10% de los pacientes no recibió
ningún tratamiento y el 26% de los pacientes no se sometió a
monitorización electrocardiográfica continua [40]; Otros
estudios también han demostrado la ausencia de una
intervención terapéutica adecuada.
de inmediato y no debe demorarse en esperar los resultados
de la determinación confirmatoria de potasio. Todas las
personas con cambios en el ECG y cualquier persona con
potasio sérico superior a 6,0 mmol / L, independientemente de
la presencia de evidencia electrocardiográfica de
hiperpotasemia, deben someterse a una monitorización
continua del ECG. Si esto requiere trasladar al paciente a una
unidad de cuidados intensivos o de cuidados intensivos, el
inicio de otro tratamiento no debe esperar a que se completen
los arreglos de transferencia. Una vez que los pacientes se
encuentran en un entorno en el que están estables y la ronda
inicial de tratamiento está en marcha, la atención debe
centrarse en identificar las condiciones que pueden haber
llevado a la hiperpotasemia [3,37].
Terapia: antagonizar los efectos celulares
de la hiperpotasemia con calcio
El calcio antagoniza directamente la despolarización del
potencial de membrana en reposo inducida por
hiperpotasemia al devolver la excitabilidad de la membrana
hacia la normalidad, cuyo mecanismo no se comprende
completamente. El efecto estabilizador de la membrana del
calcio se observa independientemente del nivel de calcio en
sangre y ocurre sin alteración de los niveles séricos de potasio.
[105]. Debe instaurarse la administración urgente de calcio intravenoso con monitorización
telemétrica continua para pacientes con cambios ECG atribuibles a hiperpotasemia
independientemente del nivel de potasio. Sin embargo, no importa qué tan alto sea el nivel de
potasio sérico, el calcio no está indicado si no hay cambios en el ECG. El calcio se puede
proporcionar como gluconato de calcio o cloruro de calcio. Dado que es más probable que el
cloruro de calcio cause necrosis tisular con extravasación, el gluconato de calcio es el fármaco
preferido [108]. La dosis recomendada es de 10 ml (1 ampolla) de gluconato cálcico al 10% (93
mg de calcio elemental) administrado en forma de inyección intravenosa durante 2 a 3
minutos [3,108]. El efecto protector del calcio se produce en minutos, pero su efecto
beneficioso es de corta duración (30-60 minutos). La dosis puede repetirse en 5 minutos si no
hay cambios en el ECG o si el ECG se deteriora después de una mejoría inicial [37,111]. Se
debe tener precaución con la administración de calcio en pacientes con sospecha de toxicidad
por digitálicos porque la administración rápida de calcio puede resultar en una disritmia fatal
[112,113]. Cabe señalar que la posibilidad de toxicidad por digitálicos no excluye la
administración de gluconato de calcio por vía intravenosa en aquellos individuos que tienen
cambios en el ECG que sugieren hiperpotasemia (como ensanchamiento del QRS y pérdida de
ondas P) [114,115]. En individuos en los que Se debe tener precaución con la administración
de calcio en pacientes con sospecha de toxicidad por digitálicos porque la administración
rápida de calcio puede resultar en una disritmia fatal [112,113]. Cabe señalar que la
posibilidad de toxicidad por digitálicos no excluye la administración de gluconato de calcio por
vía intravenosa en aquellos individuos que tienen cambios en el ECG que sugieren
hiperpotasemia (como ensanchamiento del QRS y pérdida de ondas P) [114,115]. En
individuos en los que Se debe tener precaución con la administración de calcio en pacientes
con sospecha de toxicidad por digitálicos porque la administración rápida de calcio puede
resultar en una disritmia fatal [112,113]. Cabe señalar que la posibilidad de toxicidad por
digitálicos no excluye la administración de gluconato de calcio por vía intravenosa en aquellos
individuos que tienen cambios en el ECG que sugieren hiperpotasemia (como
ensanchamiento del QRS y pérdida de ondas P) [114,115]. En individuos en los que
para la hiperpotasemia [38,42].
Pautas generales para el manejo de la
hiperpotasemia
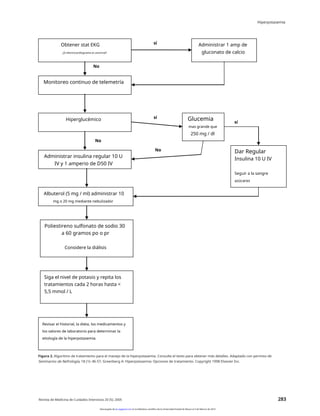
La hiperpotasemia es una verdadera emergencia médica que
debe tratarse en consecuencia. Los pasos del tratamiento se
muestran en la Tabla 2 y la Figura 2.
Faltan datos sobre qué nivel de umbral de potasio
debe tratarse. La discusión a continuación se aplica
a pacientes con hiperpotasemia grave,
correspondiente a niveles de potasio de 6,0 mmol /
L o más, un nivel en el que parece prudente iniciar
una terapia agresiva. Con grados menores de
hiperpotasemia, el tratamiento debe centrarse en
reducir el nivel de potasio eliminando el potasio del
cuerpo y previniendo la reaparición de la
hiperpotasemia al corregir su causa.
Una vez que se ha identificado a un individuo con
hiperpotasemia grave, debe determinarse inmediatamente un
nivel de potasio sérico repetido para confirmar la presencia de
hiperpotasemia, y debe obtenerse un ECG para buscar
cambios hiperpotasémicos. Si se observan cambios en el ECG,
se debe iniciar el tratamiento.
280 Revista de Medicina de Cuidados Intensivos 20 (5); 2005
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-10-320.jpg)
![Evans y Greenberg
Tabla 2. Enfoques de tratamiento para la hiperpotasemia hiperpotasemia. El efecto hipopotasémico de la insulina es
independiente de la captación de glucosa. La coadministración
de ouabaína elimina la captación de potasio sin afectar la
captación de glucosa por el músculo. Tampoco es necesaria la
reducción del nivel de glucosa sérica por la insulina, como se
muestra con el uso de la pinza euglucémica [116]. El efecto
hipopotasémico de la insulina tampoco se ve afectado por la
insuficiencia renal o el bloqueo β-adrenérgico. La liberación de
insulina estimulada por la administración de glucosa atenúa el
aumento del nivel de potasio que se observa después de una
carga de potasio. Esta atenuación no se ve disminuida por la
presencia de ESRD o por el pretratamiento con propranolol.
[117,118].
Los efectos hipopotasémicos de varias estrategias de dosificación de
insulina se han evaluado en pacientes normopotasémicos.
[119] e hiperpotasémicos [120-122] con función renal
normal y función renal alterada. En estos estudios, la
insulina se administró como una infusión continua a una
dosis de 5 mU / kg / min [119,120,122] o como una dosis
en bolo de 10 unidades de insulina regular [119] junto con
glucosa (también en forma de bolo o continua infusión a
una dosis que varía de 25 a 60 g). Ambos enfoques fueron
igualmente eficaces y redujeron los niveles séricos de
potasio en más de 0,5 mmol / L en todos los pacientes
[123]. El efecto hipopotasémico de la combinación
insulina / glucosa se demuestra tan pronto como 10
minutos después de la administración con una
disminución máxima del potasio sérico que varía de 0,65
mmol / L a 1,0 mmol / L. Este efecto máximo se observa
después de 30 [119] a 60 minutos [119,120,122] y persiste
durante 4 a 6 horas. A pesar de la equivalencia en eficacia
entre varias estrategias de dosificación de insulina, se
recomienda la administración en bolo de 10 unidades de
insulina por su facilidad de administración y control por
parte del personal de enfermería. También se deben
administrar al menos 25 g de dextrosa (1 ampolla de
dextrosa al 50%) para prevenir el desarrollo de
hipoglucemia. Entre los pacientes con niveles de glucosa
en sangre documentados superiores a 250 mg / dL, la
insulina debe administrarse sola porque la administración
adicional de glucosa puede aumentar el nivel de glucosa
sérica y provocar un desplazamiento del líquido
intracelular rico en potasio hacia el espacio extracelular,
antagonizando así el potasio. efecto reductor de la insulina
[124,125]. A pesar de la administración concomitante de
glucosa, la hipoglucemia es un efecto secundario común
de la terapia con insulina para la hiperpotasemia en
personas con ESRD. y la incidencia aumenta si se
administran menos de 40 g de glucosa [122,126]. Se ha
planteado la hipótesis de que esta hipoglucemia puede ser
causada por un defecto en la descarga simpática
contrarreguladora en individuos con ESRD.
[124]. El desarrollo de hipoglucemia se puede atenuar
cuando se coadministra insulina / glucosa con albuterol
nebulizado (ver más abajo), lo que da como resultado
Paso 1 Telemetría de electrocardiograma continuo para
potasio sérico superior a 6,0 mmol / L o si
hay anomalías en el ECG.
Si hay anomalías en el ECG, se administra por vía intravenosa.
administración de 1 ampolla (10 mL de
solución al 10%) de gluconato cálcico. Puede
repetir la dosis en 5 minutos si no hay mejoría
en las anomalías del ECG.
Administrar de forma concomitante
10 unidades de insulina regular IV y de 25 a 50 g
de glucosa si el individuo no es hiperglucémico.
Esto se puede administrar como una infusión de
250 a 500 ml de dextrosa al 10% en agua durante
1 hora o 1 a 2 ampollas de dextrosa al 50% en
agua administradas como un empujón lento. 10
a 20 mg de albuterol concentrado (5
mg / mL) vía nebulizador.
Elimina el potasio del cuerpo.
Poliestireno sulfonato de sodio (si no
indicado por la presencia de íleo u obstrucción
intestinal). Administre de 30 a 60 g en sorbitol al
70% por vía oral o como enema de retención; repita
cada 2 horas según sea necesario.
La diálisis puede estar indicada en individuos.
que reciben terapia de reemplazo renal o
aquellos con insuficiencia renal aguda.
Revisar la lista de medicamentos
1. Suspenda la administración de potasio.
2. Suspenda los medicamentos que interfieren
con la excreción de potasio.
Revise el caso de las condiciones subyacentes que
contribuyen al desarrollo de hiperpotasemia y
corrija en la medida de lo posible.
Paso 2
Paso 3
Paso 4
Paso 5
Paso 6
Hacer un seguimiento Repita el nivel de potasio sérico en 2
horas y según sea necesario. Repita los
pasos 1 a 4 si el potasio sérico sigue siendo
superior a 6,0 mmol / L en la repetición.
ECG - electrocardiograma; IV - intravenoso.
Puede haber toxicidad digitálica, se puede tener
precaución al extender el período durante el cual se
administra el medicamento de 2 a 3 minutos a un
tiempo de infusión de 20 a 30 minutos [114].
Terapia: agentes que promueven la
absorción celular de potasio
Insulina y glucosa
Como se describió anteriormente, los niveles de insulina basal
juegan un papel importante en el mantenimiento de la
homeostasis del potasio. Por lo tanto, no es sorprendente que
la insulina en dosis fisiológicas y farmacológicas sea una
herramienta útil para el tratamiento de
282 Revista de Medicina de Cuidados Intensivos 20 (5); 2005
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-12-320.jpg)
![Evans y Greenberg
una disminución de la incidencia de hipoglucemia del 75 al
20% [126]. La glucosa nunca debe administrarse sin
insulina porque la respuesta de la insulina a la glucosa y,
por lo tanto, la respuesta hipopotasémica son altamente
impredecibles.
Catecolaminas
Como se ha descrito previamente, las catecolaminas
juegan un papel importante en la regulación
extrarrenal del potasio. Su efecto está mediado por su
acción para aumentar la actividad del Na+-K+-ATPasa
que favorece la captación celular de potasio. β -
Agonistas adrenérgicos como epinefrina, albuterol,
terbutalina, salbutamol y salmeterol administrados por
vía intravenosa [20,21], mediante nebulizador (Fig 3)
[22] o mediante un inhalador de dosis medida [125]
reducen el potasio sérico de 0,5 a 1,5 mmol / L [18,22,125].
El efecto hipopotasémico de estos agentes es
independiente del pH, la aldosterona, la insulina y la vía de
administración. Se observa un efecto aditivo cuando se
utilizan agonistas β-adrenérgicos con insulina. El potasio
sérico comienza a descender tan pronto como de 3 a 5
minutos después de la administración con un efecto
máximo que ocurre a los 30 minutos cuando se administra
por vía intravenosa, a los 90 minutos cuando se administra
mediante nebulizador y a los 120 minutos cuando se
administra mediante un inhalador de dosis medida (MDI)
(Figura 4). [121]. Se ha demostrado en varios estudios que
los efectos reductores del potasio persisten al menos 6
horas con la administración intravenosa [18], 3 horas con
el uso de nebulizador [128] y 24 horas con el uso de MDI
[129]. Sin embargo, el lector no debe asumir que las
diferencias en la duración del efecto son significativas
porque las diversas vías de administración no se evaluaron
durante el mismo período de tiempo. No se ha evaluado la
persistencia del efecto más allá de los tiempos antes
mencionados. Los efectos adversos asociados con los
agonistas β-adrenérgicos incluyen taquicardia y temblores
y son más frecuentes con las formulaciones intravenosas.
Actualmente, los agonistas β intravenosos no están
disponibles en los Estados Unidos. Por lo tanto, en los
Estados Unidos, la nebulización y el inhalador de dosis
medidas son los únicos métodos de administración. La
forma preferida para la terapia nebulizada debe ser
una preparación concentrada de albuterol (5 mg / ml).
Además, la respuesta hipopotasémica a los agonistas β-
adrenérgicos administrados a personas con
insuficiencia renal es impredecible, y hasta un 40 a 50%
de los pacientes no responden al tratamiento [22,108].
Se ha postulado que esta respuesta heterogénea
puede atribuirse a la resistencia de los órganos diana
oa la presencia de un inhibidor circulante [130].
2
Fig. 3. Cambios en el potasio plasmático (mmol / L) durante la
infusión intravenosa de bicarbonato al 8.4%, epinefrina o
insulina en glucosa y durante la hemodiálisis. Las barras
verticales denotan ±SEM. Reproducido con permiso del editor
de Blumberg et al. Efecto de los enfoques terapéuticos sobre
el potasio plasmático y los principales factores reguladores en
la insuficiencia renal terminal.Revista estadounidense de
medicina 1988; 85: 507-512. Copyright 1988. Excerpta Medica
Inc.
Por tanto, los β-agonistas no se recomiendan como
monoterapia en el tratamiento de la hiperpotasemia, pero
cumplen una función coadyuvante útil con la insulina
[121,126]. El principal efecto secundario de los agonistas β
es la taquicardia, con un aumento promedio de la
frecuencia cardíaca de sólo 10 latidos por minuto con una
dosis de 10 mg de albuterol administrada por nebulizador.
Esta taquicardia moderada se tolera bien en personas sin
enfermedad cardíaca significativa. Cabe destacar que la
dosis de albuterol necesaria es aproximadamente 8 veces
la dosis estándar utilizada para la broncodilatación.
2
2
2
2
Bicarbonato de sodio
Hemos enumerado deliberadamente el bicarbonato al final de
esta discusión para enfatizar que es, en el mejor de los casos,
una terapia de tercera línea para la hiperpotasemia. El dogma
de una relación inversa entre el potasio sérico y el pH
sanguíneo está arraigado desde hace mucho tiempo en la
literatura médica. Los estudios iniciales que propusieron este
principio sugirieron que por cada disminución de 0.1 mmol / L
en el pH sérico, el potasio sérico aumentaba en 0.6
2
284 Revista de Medicina de Cuidados Intensivos 20 (5); 2005
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-14-320.jpg)
![Hiperpotasemia
potasio sérico? La mayoría de los estudios que muestran
tal efecto se originaron en la era previa a la diálisis y
describieron hiperpotasemia severa y acidosis metabólica
profunda tratadas durante un período de varios días con
bicarbonato. Tienen poca relevancia para la práctica actual
de administración de una ampolla de bicarbonato para
efectuar un cambio inmediato en el potasio sérico. No
obstante, el uso de bicarbonato de sodio se ha
recomendado ampliamente como estrategia de
tratamiento para el tratamiento de la hiperpotasemia
[134,135]. En una encuesta a directores de programas de
formación en nefrología de EE. UU., El 32% de los
encuestados recomendó la administración de bicarbonato
como tratamiento inicial [135]. En un estudio que examinó
la práctica del tratamiento para pacientes hospitalizados
en un solo centro, se observó que se utilizó bicarbonato de
sodio en el 34% de los casos [37]. Algunos estudios
pequeños han demostrado el beneficio potencial del
bicarbonato. Fraley y Adler [136] pudieron demostrar un
efecto hipopotasémico del bicarbonato de sodio que
estaba presente independientemente del pH. Ngugi et al
[121] también demostraron un efecto hipopotasémico del
bicarbonato hipertónico administrado a sujetos con
insuficiencia renal y niveles de potasio sérico superiores a
5,0 mmol / L. A pesar de estos informes de éxito, la mayor
parte de la evidencia disponible sugiere que el bicarbonato
de sodio no es útil en el tratamiento inicial de la
hiperpotasemia (Figura 3). Entre los pacientes con
hiperpotasemia, la infusión de bicarbonato de sodio no
logró reducir el nivel de potasio sérico después de 1 hora
[122]. No se observó una disminución significativa del
potasio sérico hasta después de 4 a 6 horas de infusión
continua, y la disminución de 0,66 a 0,77 mmol / L fue al
menos en parte atribuible a la dilución [118]. Blumberg et
al [122] evaluaron la eficacia de la infusión de bicarbonato
hipertónico e isotónico en sujetos con insuficiencia renal
que recibían hemodiálisis. A pesar de un aumento
significativo del bicarbonato sérico y del pH, el potasio
sérico no se redujo, 5,66 vs.
5,83 mmol / L antes y después de la infusión de bicarbonato
hipertónico y 5,39 ± 0,17 a 5,60 ± 0,27 mmol / L cuando se
mide 60 minutos después de la administración de bicarbonato
isotónico [120]. Un estudio sugirió que la infusión de
bicarbonato isotónico podría ser más eficaz que la terapia en
bolo hipertónico [138]. La administración combinada de
bicarbonato de sodio con insulina / glucosa [120,121] o
agonistas β [119] es aditiva en algunos estudios, pero no en
todos [119]. . La heterogeneidad entre las diversas
poblaciones de estudio con respecto a los niveles basales de
potasio sérico, el estado ácido-base, la duración del
tratamiento, la tonicidad de la solución de bicarbonato, la
velocidad de infusión y la dosis pueden explicar los resultados
inconsistentes.
La administración de grandes cantidades de
bicarbonato hipertónico puede precipitar hipernatremia y
Figura 4. El efecto del albuterol nebulizado, 10 mg (línea continua);
albuterol, 20 mg (línea discontinua discontinua); o placebo de
solución salina nebulizada (líneas discontinuas) sobre la
concentración plasmática de potasio de pacientes en hemodiálisis.
*PAG <.02 en comparación con el valor correspondiente para el
mismo período en el grupo de placebo; +PAG <.05 en comparación
con el valor correspondiente para el mismo período en el grupo de
albuterol, 10 mg. Todos los valores son la media ±SE. Reimpreso
con permiso del autor, Dr. Michael Allon, y el editor deAnnals of
Internal Medicine 1989; 110: 426-429.
mmol / L [131,132]. Como se mencionó anteriormente,
no todas las formas de acidosis se asocian con un
aumento del potasio sérico. La acidosis metabólica
aguda secundaria a la infusión de ácidos minerales es
la única enfermedad en la que esta relación se ha
demostrado de forma sistemática [133]. Además, la
dirección y la magnitud del cambio en el potasio sérico
parecen estar influenciadas por varios otros factores
además del cambio en el pH. Estos factores incluyen el
tipo específico de alteración ácido-base (respiratoria
frente a metabólica), su agudeza y cronicidad, y las
acciones de otros mecanismos importantes en el
mantenimiento de la homeostasis del potasio. Desde
un punto de vista terapéutico, lo que interesa es lo
contrario: elevar el bicarbonato sérico más bajo
2
Revista de Medicina de Cuidados Intensivos 20 (5); 2005 285
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-15-320.jpg)
![Evans y Greenberg
sobrecarga de volumen. El efecto reductor de potasio del
bicarbonato de sodio es pequeño, de aparición tardía e
impredecible. Por lo tanto, no se debe confiar en este agente
como tratamiento inicial o en monoterapia para tratar la
hiperpotasemia potencialmente mortal. Probablemente sea
mejor reservar su uso para pacientes que también tienen una
acidosis metabólica grave.
en 5 días separados. La excreción fecal media de potasio
fue de 54 mmol a las 12 horas después de la terapia y fue
similar en todos los grupos. Además, no hubo cambios en
el potasio sérico en ninguno de los grupos [140]. Los
autores plantean la hipótesis de que la mayor duración
requerida para el inicio del efecto de la terapia con resinas,
la entrada continua de potasio en el plasma y la
producción de diarrea secretora (que da como resultado
una contracción del volumen extracelular y acidosis)
pueden explicar la disminución insignificante del potasio
sérico a pesar de eliminación de potasio en las heces en
cantidades similares a las extraídas con hemodiálisis.
Dadas estas observaciones, las resinas aglutinantes
pueden no ser apropiadas como monoterapia en el
tratamiento de la hiperpotasemia aguda [123]. Sin
embargo, Cabe señalar que estudios previos han
demostrado una reducción eficaz del potasio sérico
durante un período de 1 a 5 días [141,142]. En un estudio,
el potasio sérico se redujo en 1,0 mmol / L en 24 horas
cuando se administró resina SPS, sola o en combinación
con insulina / glucosa o bicarbonato de sodio, por vía oral
o rectal a personas con hiperpotasemia e insuficiencia
renal aguda o crónica [139]. . Otro estudio también
demostró una reducción eficaz del potasio cuando la
resina SPS se combinó con sorbitol. Sin embargo, los
autores no recomendaron el uso de resina SPS para la
hiperpotasemia aguda debido al retraso en el inicio de la
acción [142]. Este agente es útil como monoterapia solo
para la hiperpotasemia crónica o para la hiperpotasemia
aguda moderada (concentración sérica de potasio por
debajo de 6 mmol / L) con un seguimiento cuidadoso. Con
hiperpotasemia más grave, debe combinarse con otros
agentes que tengan un inicio de acción más rápido, como
insulina / glucosa o agonistas β. Cuando se usa de esta
manera, puede retrasar u obviar la necesidad de diálisis.
Terapia: eliminación de
potasio del cuerpo
Diuréticos
Los diuréticos de asa o tiazídicos pueden tener un papel
importante en el tratamiento de la hiperpotasemia crónica
al aumentar la liberación distal de sodio y el flujo de orina,
efectos que promueven una kaliuresis. Sin embargo, su
valor en situaciones agudas es limitado. La pérdida de una
cantidad significativa de potasio requiere dosis que
causarán una natriuresis significativa. Se requerirá una
cuidadosa atención al equilibrio de líquidos. Además, la
mayoría de los pacientes hiperpotasémicos tienen
insuficiencia renal subyacente que limita la eficacia de esta
estrategia.
Resina de intercambio catiónico
El poliestireno sulfonato de sodio (SPS, Kayexalate) es una
resina de intercambio catiónico que intercambia sodio por
potasio [139]. Cuando se deja en contacto con las células
secretoras de potasio del colon durante al menos 30
minutos, cada gramo de resina se une de 0,65 a 1,0 mmol
de potasio, que puede eliminarse en las heces. Aunque
puede administrarse en forma de enema, la vía oral es
más eficaz debido a su mayor tiempo de tránsito [139]. Las
principales limitaciones de las resinas aglutinantes son el
retraso en la aparición de la diarrea osmótica durante al
menos 2 horas con el efecto máximo observado entre 4 y 6
horas [139] y el riesgo de necrosis intestinal.
[137]. Este agente no debe administrarse a personas
con evidencia de obstrucción intestinal o isquemia ni a
pacientes con trasplante renal en la etapa
posoperatoria temprana.
Aunque es un pilar de la terapia, se ha cuestionado el valor
de la resina SPS. Debido a que produce estreñimiento, la
resina SPS siempre se administra con un laxante,
generalmente como una suspensión en una solución de
sorbitol. En un estudio prospectivo cruzado [140], seis
pacientes con ERT normocalémica recibieron 5 regímenes de
resina y catárticos o catárticos solos, así como placebo.
2
Diálisis
La eliminación de potasio mediante hemodiálisis u otras
terapias de reemplazo renal es el método más eficaz para
reducir los niveles séricos de potasio. Aunque todas las
diversas modalidades de diálisis son capaces de reducir el
potasio sérico, sus velocidades de acción varían. La
hemodiálisis convencional reduce el potasio sérico más
rápidamente que la diálisis peritoneal o las terapias
continuas como la hemofiltración venovenosa continua, la
hemodiálisis venovenosa continua o la hemodiafiltración
venovenosa continua. Los estudios que evalúan la
eliminación de potasio mediante hemodiálisis han
demostrado que el potasio se elimina a una velocidad de
25 a 50 mmol / h [143,144] con una disminución
significativa de los niveles séricos de potasio en
286 Revista de Medicina de Cuidados Intensivos 20 (5); 2005
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-16-320.jpg)
![Hiperpotasemia
1,3 mmol / L que se manifiesta en la primera
hora de tratamiento. Durante la hemodiálisis
convencional, que típicamente incluye
ultrafiltración simultánea junto con diálisis, la
eliminación de potasio por ultrafiltración
representa el 15% de la eliminación de potasio y
la eliminación de diálisis representa el 85%
restante [108]. La cantidad de potasio que se
elimina con la hemodiálisis varía con la
concentración de potasio en el dializado, la
duración de la sesión de diálisis, el tamaño y las
características de permeabilidad del dializador
utilizado y la cantidad de ultrafiltración prescrita.
Además, los factores que afectan a la sangre
para dializar el gradiente de potasio alteran la
cantidad de potasio eliminada durante una
sesión de hemodiálisis [108].PAG <.001) [145].
del compartimento intracelular al extracelular hasta que
se alcanza un nuevo estado estable. Por lo tanto, un nivel
de potasio sérico posdiálisis solo puede interpretarse en el
contexto del tiempo transcurrido desde la diálisis. Los
médicos deben evitar la administración reflexiva de
potasio para corregir un valor bajo de potasio observado
al final de un tratamiento de diálisis cuando no ha habido
tiempo suficiente para que el nivel de potasio se
reequilibre. Por el contrario, un valor posdiálisis bajo no
significa que el episodio hiperpotasémico haya terminado.
El valor de potasio aumentará con el tiempo y puede
volver a alcanzar niveles de hiperpotasemia, sobre todo
cuando persista la condición que provocó la
hiperpotasemia y la disfunción renal que permitió su
desarrollo [146].
Conclusión
La hiperpotasemia es una emergencia médica que
requiere la implementación oportuna de monitoreo de
complicaciones, medidas correctivas e identificación y
tratamiento del trastorno que condujo a su desarrollo.
Dependiendo de las circunstancias, el tratamiento
incluirá antagonizar el efecto del potasio sérico
elevado, desplazar el potasio del compartimento
extracelular al intracelular y eliminar el potasio del
cuerpo. Se requiere vigilancia después del tratamiento
para asegurar que una recurrencia sea reconocida y
tratada rápidamente.
Seguimiento después del tratamiento
de la hiperpotasemia
Las terapias no dialíticas para el tratamiento de la
hiperpotasemia son un medio temporal de reducir
eficazmente el potasio sérico. Por lo tanto, después del
tratamiento inicial de las personas con hiperpotasemia, el
control continuo de la recurrencia de la hiperpotasemia es
un componente importante en el tratamiento eficaz de
esta afección. Los niveles séricos de potasio deben volver a
controlarse cada 2 a 4 horas hasta que haya disminuido la
amenaza de hiperpotasemia recurrente y se hayan
administrado dosis adicionales de glucosa e insulina o
albuterol según sea necesario (Fig. 4). La identificación y
eliminación de posibles factores causales o coadyuvantes
responsables del desarrollo de la hiperpotasemia también
son esenciales.
Una advertencia importante a considerar en la
interpretación de los niveles de potasio sérico posdiálisis es el
proceso de rebote de potasio que ocurre después de la
hemodiálisis. El rebote posdiálisis se produce porque la
hemodiálisis sólo puede eliminar el potasio del compartimento
extracelular, que representa sólo el 2% de la concentración
corporal total de potasio; el 98% restante está dentro del
compartimento intracelular. Aunque el desplazamiento
transcelular de potasio del compartimento intracelular al
extracelular se produce durante la hemodiálisis, la velocidad
no es lo suficientemente rápida para mantener el gradiente
elevado de sangre a dializado presente al inicio de la
hemodiálisis y, por tanto, este gradiente disminuye con el
tiempo [143]. Después de la hemodiálisis, el potasio continúa
cambiando
Referencias
1. Conferencia de Davy H. Bakerian. Transacciones filosóficas de
la Royal Society. 1808; 98: 1-44.
2. Smith EF James Woodhouse: un pionero de la química.
Filadelfia, Pensilvania: John C. Winston; 1918.
3. Greenberg A. Hiperpotasemia: opciones de tratamiento. Semin
Nephrol. 1998; 18: 46-57.
4. Forbes G, Lewis A. Sodio, potasio y cloruro totales en el
hombre adulto. J Clin Invest. 1956; 35: 596-602.
5. Sterns R, Cox M, Feig P, Singer I. Balance de potasio
interno y control de la concentración plasmática de
potasio. Medicamento. 1981: 60: 339-354.
6. Marrón RS. Homeostasis del potasio extrarrenal.Riñón Int.
1986; 30: 116-127.
7. Clausen T, Everts M. Regulación de la bomba de Na K en los
músculos esqueléticos. Riñón Int. 1989; 35: 1-13.
8. Wright F, Giebisch G. Transporte de potasio renal:
contribuciones de segmentos y poblaciones de nefronas
individuales. Soy J Physiol. 1978; 235: F515-F527.
9. Giebish G. Un rastro de investigación sobre el potasio. Riñón Int.
2002: 62: 1498-1512.
10. Young DB, Smith MJ Jr, Jackson TE, Scott RE. Interacción
multiplicativa entre la concentración de angiotensina II y K en
la estimulación de la aldosterona.Soy J Physiol. 1984; 247:
E328-E335.
11. Basti C, Hayslett J. La acción celular de la aldosterona en el
epitelio diana. Riñón Int. 1992; 42: 250.
Revista de Medicina de Cuidados Intensivos 20 (5); 2005 287
Descargado de jic.sagepub.com en la biblioteca científica de la Universidad Estatal de Moscú el 3 de febrero de 2014](https://image.slidesharecdn.com/manejodehiperkalemia-211006100016/85/Manejo-de-hiperkalemia-en-es-17-320.jpg)


