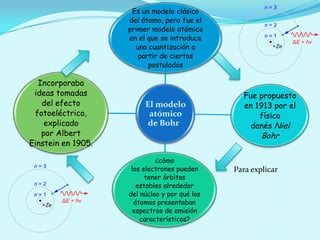
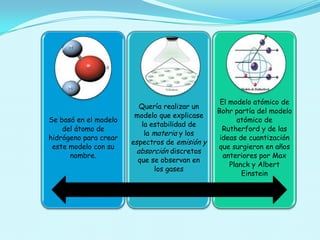
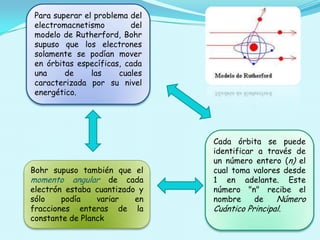
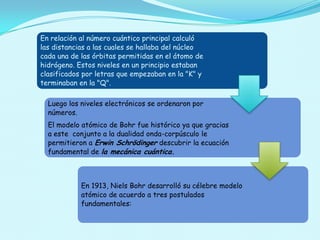
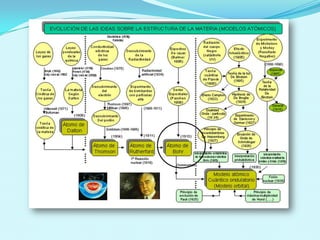
El documento describe el modelo atómico de Bohr propuesto en 1913, que introdujo la cuantización de los electrones en órbitas específicas alrededor del núcleo. Este modelo se basa en postulados que explican la estabilidad de la materia y los espectros de emisión característicos de los átomos. Además, presenta cómo se derivan las energías de las órbitas permitidas y su relación con las transiciones energéticas de los electrones.