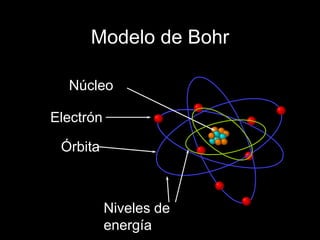
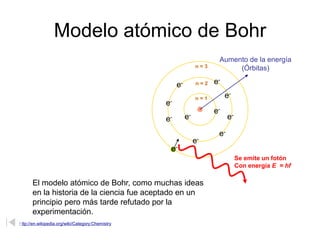
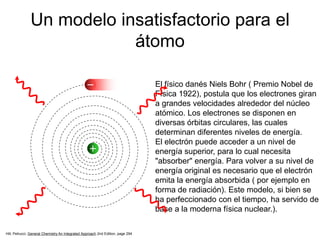
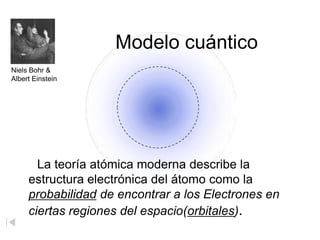
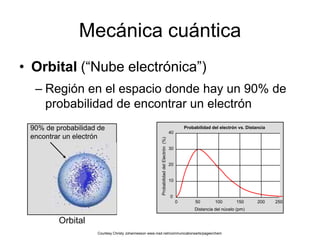
El modelo atómico de Bohr, propuesto por Niels Bohr, describe a los electrones girando en órbitas alrededor del núcleo atómico, con diferentes niveles de energía que permiten la absorción y emisión de fotones. Aunque fue un avance inicial en la comprensión del átomo, ha sido refutado y perfeccionado por la teoría cuántica moderna, que considera a los electrones en términos de probabilidades en regiones de espacio denominadas orbitales. En la visión contemporánea, el átomo está compuesto principalmente de espacio vacío, con un núcleo de protones y neutrones y una nube electrónica donde se puede encontrar a los electrones.