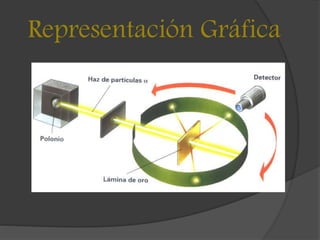
Ernest Rutherford, físico y químico neozelandés, propuso en 1911 un modelo atómico que introdujo el concepto de un núcleo pequeño y cargado positivamente, con electrones orbitando a su alrededor, basado en su experimento con una lámina de oro. Su modelo refutó la teoría de Thomson al demostrar que los átomos están mayormente vacíos y que la masa se concentra en el núcleo. Sin embargo, el modelo enfrenta limitaciones debido a la predicción de que los electrones perderían energía y colapsarían en el núcleo según las leyes de la física clásica.